اهمیت تست های بیوشیمیایی در آزمایشگاه
در آزمایشگاه های تحقیقاتی و تشخیص طبی برای شناسایی و تشخیص باکتری ها می توان از تست های بیوشیمیایی مختلفی استفاده کرد. با استفاده از تست های بیوشیمیایی و استفاده از محیط های کشت اختصاصی می توان باکتری مورد نظر و سویه ها را تفکیک کرد.
در این مقاله آموزشی انواع مختلف تست های بیوشیمیایی را بررسی خواهیم کرد که در پایان باید بتوانیم به پاسخ سوالات زیر دست پیدا کنیم در چه مواردی از تست های بیوشیمیایی استفاده می شود؟
1- تست اکسیداز| Oxidase Test
آزمایش اکسیداز یکی دیگر از تست های بیوشیمیایی است که در ابتدا برای باکتری نایسریا ابداع و سپس برای گروه انتروباکتریاسه استفاده شد. برای بررسی وجود آنزیم سیتوکروم اکسیداز(انتقال الکترون در تنفس هوازی) استفاده می شود و تست افتراقی برای تمایز گونه های سودوموناس، نایسریا، موراکسلا،ویبریو، کمپیلوباکتر، پاستورلا و بروسلا می باشد.
از میان باکتری های بیماریزای گرم منفی نایسریا و پسودوموناس از نظر اکسیداز مثبت می باشند، در حالیکه خانواده انتروباکتریاسه اکسیداز منفی بوده و با انجام این تست ساده قابل افتراق هستند.
آنزیم های اکسیداز نقش بسیار مهمی را در سیستم انتقال الکترون در تنفس هوازی ایفا می کنند. در این سیستم سیتوکروم اکسیداز اکسیژن با به عنوان گیرنده الکترون مورد استفاده قرار می دهد.
توانایی باکتری ها در تولید آنزیم سیتوکروم اکسیداز را می توان با انجام تست اکسیداز(Oxidase Test) مشخص نمود. آنزیم سیتوکروم اکسیداز قادر به اکسید کردن سوبسترای تترامتیل-پار-فنیلن دی آمین- دی هیدروکلراید و تشکیل محصول رنگی ایندوفنل (Indophenol) می باشد. اگر مقدار کمی از ارگانیسم تولید کننده این آنزیم را بر روی یک تکه کاغذ آغشته به سوبسترا بمالیم، رنگ ارغوانی تیره ای ایجاد می شود. این سوبسترا در حضور آنزیم اکسیداز و اکسیژن آزاد به عنوان دهنده الکترون عمل کرده و در اثر اکسید شدن به ترکیب سیاه رنگی تبدیل می شود.
باکتری هایی که اکسیداز منفی دارند ممکن است بی هوازی ، هوازی یا اختیاری باشند ؛ نتیجه منفی اکسیداز فقط به این معنی است که این موجودات سیتوکروم c اکسیداز ندارند که واکنش دهنده را اکسید می کند. آنها ممکن است با استفاده از دیگر اکسیدازها در انتقال الکترون تنفس کنند.)
تست های بیوشیمیایی : پروتکل/دستورالعمل آزمایش اکسیداز

2-تست اوره آز | Urease Test
دومین مورد از تست های بیوشیمیایی اوره آز نام دارد. برخی باکتری های آنزیمی به نام اوره آز (urease) تولید می کنند که قادر است ترکیبات آمیدی نظیر اوره را تجزیه نموده و آن را به آمونیاک، دی اکسید کربن و آب تبدیل کند.
درخانواده انتروباکتریاسه از میان باکتری های لاکتوز منفی تعدادی از آنها از جمله پروتئوس، پروویدنسیا و مورگانلا به دلیل فعالیت اوره آز(Urease Activity) از باکتری های دیگر این گروه نظیر سالمونلا و شیگلا قابل افتراق هستند.
شایان ذکر است پروتئوس میرابیلیس یکی از عوامل مهم عفونت ادراری در انسان می باشد. همچنین تست اوره آز جهت شناسایی گونه های مهمی نظیر کورینه باکتریوم اوره آلیتیکوم، هلیکوباکترپیلوری، تشخیص مخمر های کپسول دار و به عنوان یک تست اضافی برای تشخیص بعضی کوکوباسیل های گرم منفی به کار می رود.
فعالیت اوره آز باکتری ها را می توان با کشت باکتری در محیط حاوی اوره و با کمک معرف فنل رد بررسی نمود. به دنبال هیدرولیز اوره و تجمع آمونیاک PH محیط قلیایی می شود. بالا رفتن PH موجب تغییر رنگ معرف از قرمز پرتقالی به صورتی پررنگ یا قرمز ارغوانی می شود. عدم مشاهده رنگ صورتی پررنگ یا ارغوانی نشانه منفی شدن تست اوره آز است
تست های بیوشیمیایی : پروتکل/دستورالعمل آزمایش اوره آز


برای آموزش انواع تست های بیوشیمیایی و سایر تکنیک های مورد نیاز برای آزمایشگاه میکروبیولوژی
از طریق لینک دوره های آموزشی تخصصی آزمایشگاه می توانید اقدام نمایید.
3-تست کاتالاز | Catalase Test
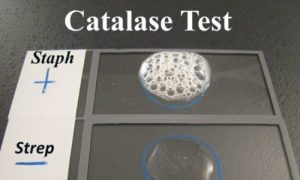
یکی دیگر از تست های بیوشیمیایی تست کاتالاز(catalase test) است که کلید تشخیصی مهمی برای شناسایی و افتراق باکتری ها می باشد برای مثال: می توان استرپتوکوک (کاتالاز منفی) را از استافیلوکوک و میکروکوک (کاتالاز مثبت) افتراق داد. برای افتراق کلستریدیوم ها (کاتالاز منفی) از باسیلوس ها (کاتالاز مثبت) و لیستریا مونوسیتوژنز(کاتالاز مثبت) از استرپتوکوک های بتا همولیتیک (کاتالاز منفی) بکار می رود.
کاتالاز مادهای است که از چهار زنجیرهی پلی پپتیدی تشکیل شده که هر کدام دارای بیش از ۵۰۰ آمینو اسید است. این شامل چهار پورفیرین است که اجازهٔ واکنش با آب اکسیژنه را میدهد. حالت مطلوب برای PH کاتالاز انسان تقریباً هفت است. حالت مطلوب برای بقیهٔ کاتالازها بین چهار تا یازده است که به نوع انها بستگی دارد.
آنزیم کاتالاز از دیوارهٔ سلولی ترشح میشود و در بدن انسان در دمای ۳۷ درجه فعالیت میکند، دمایی که تقریباً با دمای بدن یکسان است.
تعدادی از باکتری ها، فلاوپروتئین هایی دارند که قادر است اکسیژن (O2) را احیا کرده و پراکسید هیدروژن (H2O2) یا سوپراکسید ( -O2) تولید کند. محصولات یاد شده بسیار سمی بوده و باعث تخریب ساختمان سلولی می شود بنابراین باکتری باید قادر باشد که در مقابل محصولات سمی اکسیژن از خود محافظت نماید، در غیر این صورت محکوم به مرگ خواهد بود.
بسیاری از باکتری ها آنزیم هایی دارند که آنها را در مقابل محصولات سمی اکسیژن محافظت می نماید. باکتری های هوازی اجباری و هوازی بی هوازی اختیاری معمولا دارای آنزیم سوپراکسید دیسموتاز می باشند، این آنزیم، سوپراکسید را تجزیه و پراکسید هیدروژن تولید می کند، در مرحله بعدی پراکسید هیدروژن توسط آنزیم کاتالاز یا پراکسیداز مطابق واکنش های زیر تجزیه می شود؛
باکتری های بی هوازی فاقد آنزیم های فوق بوده و بنابراین قادر به تحمل اکسیژن نیستند.حضور آنزیم کاتالاز را می توان با افزودن چند قطره پراکسید هیدروژن بر سطح کلنی باکتری در محیط Trypticase Soy Agar شناسایی کرد اگر باکتری آنزیم کاتالاز داشته باشد طبق واکنش های اشاره گاز اکسیژن تولید می شود و حباب های گاز اکسیژن بر سطح کلنی بیانگر مثبت شدن تست کاتالاز است و عدم تولید گاز نشان دهنده منفی شدن این تست می باشد.
تست های بیوشیمیایی کاتالاز را می توان بر روی لام شیشه ای نیز انجام داد.
تست های بیوشیمیایی : پروتکل/دستورالعمل آزمایش کاتالاز
4-تست کواگولاز و DNase
یکی از تست های بیوشیمیایی دیگر تست کواگولاز است که در آزمایشگاه های تشخیص طبی کاربرد دارد و با استفاده از آن می توان استافیلوکوک های بیماری زا(مثبت) را از سویه های غیر بیماری زا (منفی) افتراق داد. آنزیم کواگولاز با مکانیسمی شبیه مکانیسم اصلی لخته شدن، پلاسمای خون را لخته می کند.
هرچند حضور این آنزیم برای بیماری زایی ضروری نیست، ولی شاخص خوبی برای شناسایی باکتری های بالقوه پاتوژن استافیلوکوک اورئوس می باشد. باکتری های تولید کننده کواگولاز رشته های فیبرینی در اطراف خود تنیده و از سیستم ایمنی میزبان فرارمی کنند. در عفونت های استافیلوکوکی ایجاد لخته فیبرینی باعث محدود شدن یا موضعی شدن عفونت می شود.
تست کواگولاز به 2 صورت اسلایدی/لامی و لوله ای انجام می شود.
آنزیم کواگولاز به دو شکل متصل و آزاد وجود دارد:
متصل (Bound Coagulase) به دیواره سلولی باکتری متصل است. برای بررسی فعالیت آنزیم متصل، آزمون لامی(Silde test) بکار می رود. فعالیت کواگولاز متصل با آنتی بادی تولید شده بر علیه کواگولاز آزاد مهار نمی شود.
آزاد (Free Coagulase) ترکیبی شبیه ترومبین است که توسط باکتری تولید و در محیط آزاد می شود. کواگولاز آزاد به واسطه فاکتور فعال کننده، در پلاسما به آنزیمی کارآمد تبدیل شده و با روشی مشابه ترومبین، لخته فیبرین ایجاد می کند.
استافیلوکوک های کواگولاز مثبت با استفاده از این آنزیم پلاسما را لخته می کند. در تست کواگولاز پلاسمای مورد استفاده بوسیله سیترات یا EDTA از نظر لخته شدن غیر فعال می شود تا تداخلی در آزمایش ایجاد نکند.
علاوه بر آنزیم کواگولاز، اکثر گونه های بیماری زای استافیلوکوک آنزیم DNase تولید می کنند. این آنزیم با تجزیه DNA سلول های میزبان ویرولانس باکتری را افزایش می دهد. برای نشان دادن حضور DNase، باکتری را در محیط حاوی DNA کشت می دهند.
وجود هاله شفاف در اطراف کلونی باکتری بیانگر مثبت شدن تست DNase است. این هاله در نتیجه تجزیه ی مولکول های درشت DNA توسط آنزیم DNase و حل شدن محصول نهایی در اسید اضافه شده به محیط به وجود می آید. DNA تجزیه نشده در اسید ضعیف حل نمی شود، بلکه به وسیله آن رسوب می کند، بنابراین محیط اطراف کلونی که از نظر DNase منفی است، کدر دیده می شود.
نکات مهم در خصوص کواگولاز از تست های بیوشیمیایی:
۱. آزمون کواگولاز لامی به عنوان آزمون فرضی به شمار می رود و در صورتی که جواب منفی یا مثبت تاخیری داشت باید حتما با آزمون لوله ای تایید شود. زیرا بعضی از سویه های استافیلوکوک اورئوس کواگولاز آزاد تولید می کنند که در آزمون لامی شناسایی نمی شود.
۲. توصیه می شود لوله آزمون کواگولاز در فواصل زمانی ۳۰ دقیقه حداکثر تا ۴ ساعت مورد بررسی قرار گیرد و اگر پس از این مدت لخته مشاهده نشد نتیجه آزمون منفی گزارش می شود. برخی از سویه های استافیلوکوک اورئوس حدود ۱۸ تا ۲۴ ساعت پس از کشت، آنزیم فیبرینولیزین تولید می کنند که باعث باز شدن لخته فیبرینی می شود، بنابراین اگر لوله آزمایش کواگولاز در ۴ ساعت اول مورد بررسی قرار نگیرد ممکن است جواب منفی کاذب ایجاد نماید.
۳. در تست کواگولاز لوله ای پس از تلقیح باکتری به پلاسمای سیتراته از مخلوط کردن آن بوسیله ورتکس یا شیکر خودداری کنید.
۴. در صورت مثبت بودن تست DNase هاله شفاف اطراف کلنی باید به سرعت قابل مشاهده باشد.
تست های بیوشیمیایی : پروتکل/دستورالعمل آزمایش کواگولاز

برای دریافت خدمات آزمایشگاه میکروبیولوژی و انجام انواع تست های بیوشیمیایی
از طریق لینک خدمات آزمایشگاهی می توانید اقدام نمایید
5-آزمایش اکسیداسیون یا تخمیر گلوکز | OF Test
یکی از مهمترین خصوصیات افتراقی باکتری های گرم منفی غیر تخمیری از انتروباکتریاسه، توانایی ارگانیسم در استفاده از کروبوهیدرات ها می باشد. در این آزمایش از تست های بیوشیمیایی از محیطی به نام Oxidative Fermentative Media که دارای مقادیر بسیار کمی پیتون است، استفاده می شود. هرچند محیط TSI و یا KIA تخمیر و عدم تخمیر قند را نشان می دهد، ولی به علت بالا بودن مقدار پیتون در محیط، مقادیر کم اسید خنثی می شود. بنابراین پاسخ درستی ارائه نمی گردد. ولی محیط OF دارای پیتون کم و مقدار بیشتری کربوهیدرات است.
کاهش میزان پروتئین، تولید آمین های قلیایی را که مقادیر اندک اسید ناشی از اکسیداسیون قند را خنثی می کنند، کاهش داده و در نتیجه تولید مقدار کم اسید نیز مشخص می شود. همچنین با افزایش نسبی میزان قند محیط کشت OF مقدار اسید حاصل از اکسیداسین افزایش می یابد. در محیط کشت OF قدرت تحرک باکتری نیز مشخص می گردد.
برای کشت بر روی این دو محیط از دو لوله استفاده می شود. ارگانیسم جدا شده را در هر دو محیط تلقیح کرده و سپس یکی از محیط ها را با پارافین استریل پوشانده که شرایط بی هوازی ایجاد شود.
بعد از انکوباسیون در لوله هایی که رنگ زرد ایجاد شده، اسید تولید و گلوکز مصرف شده است.در لوله واجد پارافین (شرایط بی هوازی) عمل تخمیر و در لوله ی فاقد پارافین (شرایط هوازی) عمل اکسیداسیون صورت می گیرد.
این محیط دارای قند گلوکز و معرف برموتیمول بلو می باشد. اگر گلوکز محیط مصرف شود، اسید تولید می شود و برموتیمول بلو از حالت سبز به زرد تغییر رنگ می دهد. اگر هر دو لوله (با یا بدون روغن) زرد شود، میکروارگانیسم بی هوازی اختیاری می باشد، یعنی توانایی استفاده از گلوکز را در حضور یا عدم حضور اکسیژن دارد. در صورتی که فقط در لوله بدون روغن رنگ زرد ایجاد شود، باکتری هوازی است و توانایی استفاده از گلوکز را تنها در حضور اکسیژن دارا می باشند. عدم تغییر رنگ در لوله نشانه این است که میکروارگانیسم قادر به مصرف گلوکز نمی باشد.
باسیل های گرم منفی غیرتخمیری فاقد اسپور، هوازی وغالبا متحرک می باشد. در شرایط بی هوازی فقط نمونه هایی رشد می کنند که قادر به استفاده از نیترات یا آرژنین به عنوان گیرنده نهایی الکترون باشند.
در بررسی های آزمایشگاهی، ابتدا باید آنها را از انتروباکتریاسه تشخیص داد. انتروباکتریاسه ها همگی اکسیداز منفی می باشند ولی در مقابل باسیل های گرم منفی غیر تخمیر کننده اکسیداز مثبت یا منفی می باشند.آزمایش اکسیداز، توانایی رشد در محیط مک کانکی آگار، توانایی استفاده از کربوهیدرات ها و نوع مسیر متابولیکی که توسط میکروارگانیسم مورد استفاده قرار می گیرد. برای تشخیص جنس باکتری در ابتدا از چند آزمایش استفاده می شود که عبارتند از:
تست های بیوشیمیایی : پروتکل/دستورالعمل آزمایش OF

6-تست TSI
آزمایش TSI برای شناسایی اعضای خانواده انتروباکتریاسه به کار می رود. همچنین این تست برای افتراق انتروباکتریاسه از سایر باسیل های روده ای گرم منفی استفاده می شود. محیط کشت TSI حاوی ۱ درصد لاکتوز، ۱ درصد ساکارز و ۱/۰ درصد گلوکز می باشد. اختلاف در غلظت این قند ها به منظور تشخیص توانایی مصرف آنها است. معرف فنول رد به عنوان شاخص PH تغییرات اسیدیته محیط را که نتیجه تخمیر کربوهیدرات ها می باشد، نشان می دهد.
بطوری که تولید اسید ناشی از تخمیر قند را با تغییر رنگ قرمز به زرد نشان می دهد.در این محیط تیوسولفات سدیم و سولفات آهن ll نیز وجود دارد، تیوسولفات سدیم سوبسترای تولید H2S و سولفات آهن به عنوان معرف رنگی عمل می کند و در حضور H2S رسوب رنگی تشکیل می دهد.
البته می توان برای بررسی الگوی مصرف قند و تولید گاز H2S از محیط Kligler Iron Agar نیز استفاده نمود. در محیط اخیر تست های مشابه محیط TSI قابل انجام است. کشت در محیط TSI به صورت کشت عمقی و کشت سطحی زیگزاگ در سطح شیبدار انجام می گیرد. سپس به مدت ۱۸ تا ۲۴ ساعت در ۳۵ درجه سانتیگراد نگهداری و سپس از نظر تخمیر قندی، تولید گاز و تولید H2S مورد بررسی قرار می گیرند. واکنش های محیط TSI به اشکال زیر مشاهده می شود:
۱.سطح شیبدار قرمز (قلیایی) و عمق لوله زرد (اسیدی)- در این حالت فقط گلوگز تخمیر شده است و تولید مقادیر اندک اسید باعث تغییر رنگ محیط به زرد می شود، از آنجایی که غلظت گلوکز کم است، به سرعت تمام شده و باکتری برای تامین انرژی مورد نیاز خود از ترکیبات دیگر محیط استفاده می کند، در چنین مواردی اگر باکتری توانایی تخمیر لاکتوز را نداشته باشد از ترکیبات پیتونه استفاده کرده و با تولید یون آمونیوم باعث قلیایی شدن سطح شیبدار محیط کشت و تغییر رنگ قرمز این ناحیه می گردد ولی به دلیل کمبود اکسیژن در بخش عمیق لوله رشد باکتری کند بوده و به همین جهت بخش عمیق لوله همچنان زرد رنگ باقی می ماند.
۲.سطح شیبدار زرد (اسیدی) و عمق لوله زرد( اسیدی)-این حالت نشان دهنده تخمیر لاکتوز و یا ساکارز می باشد و به علت غلظت بالای این دو قند و تولید مقادیر زیاد اسید، کل محیط به رنگ زرد در می آید.
۳.سطح شیبدار قرمز(قلیایی) و عمق لوله قرمز(قلیایی)-این حالت نشان می دهد که هیچکدام از قند های محیط تخمیر نشده و تولید اسید، گاز و گاز H2S منفی است. بجای آن پیتون ها تحت شرایط هوازی یا بی هوازی مصرف شده و با تولید آمونیاک باعث قلیایی شدن محیط می شود.
۴. شکستن، ترک خوردن و یا بالا آمدن محیط کشت در داخل لوله- این حالت نشان دهنده تولید گاز متعاقب تخمیر قندی می باشد و باکتری هایی که از تخمیر قند، اسید و گاز تولید می کنند، ضمن اسیدی کردن محیط (رنگ زرد) باعث ترک خوردگی یا بالا آمدن محیط می گردند.
۵.سیاه شدن محیط کشت-برخی باکتری ها تیوسولفات سدیم را به سولفیت و گاز H2S احیا می کنند و گاز H2S در حضور سولفات آهن رسوب سیاه رنگ سولفید آهن را ایجاد می کند.
تست های بیوشیمیایی : پروتکل/دستورالعمل آزمایش TSI

بیشتر بخوانید:










































