سنتز cDNA
سنتز cDNA و کاربردهای آن
Complementary DNA(cDNA) به نوعی از DNA گفته می شود که توسط آنزیم ریورس ترانسکریپتاز از روی mRNA بالغ ساخته می شود. در مواردی که عفونت با ویروسهای RNAدار اتفاق افتاده باشد شروع واکنش تکثیر به جای DNA از mRNA می باشد که به آن RT-PCR (Reverse transcription PCR) گفته می شود. آنزیم RT معمولا در ویروس ها وجود دارد و بر روی RNA تک رشته ای عملکرد دارند. این آنزیم در دهه ۱۹۷۰ از رتروویروسها استخراج شد که در واقع یک DNA پلیمراز وابسته به RNA هست که چندین نوع از این آنزیم وجود دارد: AMV ،MMLV ،HIV-1 و آنزیم رونوشت بردار معکوس تلومرازی.
عمدتا از cDNA برای کلون کردن ژن یا به عنوان پروب یا برای ساخت کتابخانه cDNA به منظور حذف نواحی غیر کننده و عناصر تنظیمی موجود در DNA ژنومی استفاده می شود. همچنین جهت کلون کردن و بیان ژن های یوکاریوتی در پروکاریوت ها و در شرایطی که یک نوع پروتئین در سلول هدف بیان نشود cDNA به آن وارد می کنند که ژنوم پروتئین به DNA میزبان آسیب نرساند.
برای بررسی میزان بیان ژن ها به تعیین مقدار mRNA نیاز داریم که در واقع می توان گفت اولین گام برای انجام آزمایش Real Time PCR، سنتز cDNA و استفاده از تکنیک RT-PCR می باشد. به دلیل اینکه آنزیم DNA پلیمرازی که برای سنتز رشته های جدید در انواع PCR استفاده می شود قادر به استفاده از RNA به عنوان الگو نیست.
Pro-Tips هنگام سنتز
- تمامی تیپ ها و تیوب هایی که استفاده می کنیم باید DEPC treated باشند تا خطر تجزیه RNA توسط RNaseها کاهش یابد(دی اتیل پیروکربنات یا DEPC غیرفعال کننده آنزیم های RNase در آب است).
- برای جلوگیری از آلودگی، درب تمامی محلول ها در زمانی که مورد استفاده قرار نمی گیرند باید کاملا بسته باشند.
- از دستکش های RNase free استفاده کنیم و در صورت گمان به احتمال آلودگی آنها را سریعا تعویض نماییم.
- از مهارکنندههای ریبونوکلئاز(RNase Inhibitor) جهت مهار فعالیت RNase و محافظت از RNA استفاده کنیم.
استفاده از پرایمرها برای سنتز
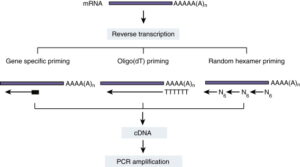
از جمله مواد مهم برای سنتز cDNA پرایمرها هستند که برای انجام این کار 3 نوع پرایمر وجود دارد:
پرایمرهای Random Hexamer
توالی های کوچک 6 نوکلئوتیدی که به صورت تصادفی به هر جایی از RNA امکان اتصال دارند. این پرایمرها زمانی که بخواهیم بیان تمام ژن ها را تحت هر شرایطی با هر ژن کنترلی حتی rRNA 18s بررسی کنیم کاربرد دارد.
پرایمرهای OligodT
این پرایمرها به انتهای mRNA دارای توالی polyA متصل می شوند.
پرایمرهای اختصاصی
این پرایمرها برای نقاط شناخته شده ای از mRNA ها با توالی مشخص طراحی می شوند و در واقع باعث بهینه سازی توالی مورد نظر می گردند و در کلونینگ کاربرد دارند. مواد دیگری که در سنتز cDNA نقش دارند شامل نوکلئوتیدها( dNTPها)، بافر آنزیم RT، آنزیم ریبونوکلئاز و RNase H که وظیفه ی جداسازی دو رشته ی RNA و cDNA سنتز شده از هم را دارد، می باشد. که معمولا همه این مواد به صورت مخلوطی در کیت های سنتز cDNA در ویالی تحت عنوان Master Mix موجود می باشد و نیازی به افزودن آن ها به صورت جداگانه نیست.
-
نکات مهم در خصوص استفاده از پرایمرها
اگر ژن مورد بررسی کدینگ باشد بهتر است به عنوان فیلتر از پرایمرهای Oligo dt استفاده نماییم و اگر در مطالعه ژن های non Coding داشته باشیم یا پروکاریوت باشد(به دلیل نداشتن دم PolyA) استفاده از این پرایمرها کاربردی نیست.
به طور معمول از پرایمرهای Random Hexamer و OligodT برای آزمایش های تحقیقاتی و از پرایمرهای اختصاصی برای آزمایش های کلینیکال استفاده می شود.
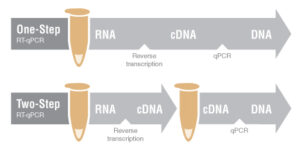
انواع کیت های سنتز
برخی کیت ها به صورت One step و برخی Two step می باشند. در حالت Two step ابتدا سنتز cDNA در یک ویال انجام می شود و سپس PCR معمولی در جهت بررسی بیان ژن cDNA سنتزشده در ویالی دیگر انجام می شود. این کیت ها دقت بیشتری دارند و Trouble shooting هر مرحله آسان تر می باشد اما نقطه ضعف روش دو مرحله ای، حساسیت به آلودگی به دلیل جابجایی نمونه ها است.
در حالت One step همه ی مراحل سنتز cDNA تا بیان ژن در یک ویال انجام می گیرد و برای افرادی که تسلط زیادی دارند مناسب تر است. برای انجام این تکنیک ابتدا استخراج RNA موجود در نمونه مورد نظر انجام می شود. RNA استخراج شده جهت سنتز cDNA باید کیفیت و غلظت مناسبی داشته باشد چون چیزی معادل 1μg یا همان 1000ng از RNA در هر بار استفاده جهت سنتز مورد نیاز است. سپس RNA مورد نظر را با موادی که در بالا گفته شد بر روی یخ مخلوط کردیم ویال را به دستگاه ترموسایکلر منتقل می کنیم تا دماهای لازم را با برنامه زمانی که بسته به کیت متفاوت است اعمال کنیم.
کیت های One step فقط در فاز کلینیکال استفاده می شوند اما کیت های Two step هم برای آزمایش های تحقیقاتی و هم کلینیکال مورد استفاده قرار می گیرند. محصولات RT-PCR را می توان با الکتروفورز ژل آنالیز کرد.
مراحل مشترک در کیت های سنتز
افزایش دما تا 65 درجه به مدت 5 دقیقه برای باز شدن پیچ و تاب ها و ساختار های ثانویه RNA دمای حدود 40 (42-37) درجه به مدت یک ساعت به منظور فعال شدن آنزیم RT که این دما بسته به نوع آنزیم RT می تواند تغییر کند. دمای 80-70 در حدود 5 دقیقه برای غیر فعال کردن آنزیم RT cDNA سنتز شده را می توان در دمای 20- درجه به مدت طولانی نگهداری کرد و دیگر استرس تخریب آن با آنزیم RNase که در محیط فراوان است را نیز نداشت.
برای بررسی کیفیت cDNA باید برای یک ژن House keeping که میزان بیان آن در همه سلول ها تحت هر شرایطی یکسان است به عنوان مبنا و رفرنس یک PCR معمولی بگذاریم و نتیجه را روی ژل آگارز مشاهده کنیم چنانچه باند واضح یا SHARP و در جایگاه درستی از لحاظ طول بود نتیجه می گیریم کیفیت cDNA مناسب است و با خیال راحت می توانیم به سراغ انجام مراحل بعدی RealTime PCR جهت بررسی بیان ژن ها رفت.
تکنیک RT-PCR
RT-PCR فناوری است که توسط آن مولکولهای RNA توسط رونوشتهای معکوس به توالیهای DNA مکمل (cDNA) خود تبدیل میشوند و به دنبال آن cDNA جدید سنتز شده توسط روشهای PCR استاندارد تقویت میشود. این رویکرد برای مطالعه بیان ژن به دلیل نقش رونوشت معکوس (RT) در سنتز cDNA رشته الگو به عنوان RT-PCR شناخته می شود.
RT-PCR یک فرآیند دو مرحله ای است. این شامل رونویسی معکوس RNA خالص شده توسط RT و تقویت cDNA رشته الگو با استفاده از برخی از انواع PCR است. نرمال سازی نمونه ها در RT-PCR بسیار مهم است و کارایی سنتز cDNA رشته اول یکی از مهمترین عوامل تعیین کننده در موفقیت یا شکست این روش است. به همین دلیل، از نظر استراتژیک بهتر است که یک منبع cDNA بزرگ بسازیم که از آن مقادیر جزئی برای کاربردهای فردی گرفته شود تا اینکه واکنش سنتز cDNA را بارها و بارها تکرار کنیم.
طراحی پرایمرهای مفید نیز مستلزم ایجاد تعادل مناسب بین ویژگی الگو، پایداری ترمودینامیکی هنگام جفت شدن پایه با الگو، و ظرفیت یک پرایمر برای عملکرد با دیگری برای پشتیبانی از RT-PCR است. رفتار مشترک احتمالی یک یا چند جفت آغازگر الیگونوکلئوتیدی به بهترین وجه بر حسب Tm هر آغازگر درگیر توصیف می شود. Tm دمایی است که در آن 50 درصد از رویدادهای بازپخت احتمالی بین پرایمر و الگو رخ داده است و 50 درصد هنوز رخ نداده است.
پروتکل آزمایش
- مرحله آمادهسازی:
در این مرحله استخراج کل RNA موجود در نمونه مورد نظر انجام میگیرد. پرایمرها نیز برای ژنی که قرار است تکثیر شود، طراحی و سفارش داده میشوند. کیتهای آمادهای برای استخراج RNAها وجود دارند که با ترکیب شدن با RT-PCR باعث میشوند که آنالیز RNA نیز در آزمایشگاههای بالینی به حساسیت و سرعت تکثیر DNA با استفاده از PCR شود.
- گام اول: بازکردن RNAها؛
در این مرحله با افزایش دما تا ۶۵ درجه سانتیگراد به مدت ۵ دقیقه، ساختارهای ثانویه و پیچوتابهای RNAهای موجود در نمونه از همدیگر باز میشوند.
- گام دوم: واکنش Reverse transcriptase؛
در این مرحله آنزیم Reverse transcriptase برای سنتز DNA از mRNA مورد استفاده قرار میگیرد؛ در واقع آنزیم Reverse transcriptase از mRNAها به عنوان الگویی برای تولید قطعات DNA تکرشتهای موسوم به cDNA استفاده میکند. آنزیم Reverse transcriptase مرود استفاده در واکنش دارای سه ویژگی اساسی است: ۱. سنتز DNA را با استفاده از الگوی RNA انجام میدهد؛ ۲. رشته RNA را از رشته DNA جدا میکند (RNase H activity)؛ ۳. رشته DNA دوم را بر روی DNA الگو سنتز میکند.
طی این فرایند، RNAهای دناتوره شده در اثر حرارت، بافر RT، dNTPها، پرایمرها، آنزیم Reverse transcriptase به همراه سایر مواد موردنیاز در لوله PCR قرار داده شده و به مدت یک ساعت و در دمای ۴۲-۳۷ درجه سانتیگراد انکوبه میشوند. DNAهای تکرشتهای حاصل از این واکنش به مدت ۲ دقیقه در دمای ۹۵ درجه سانتیگراد حرارت داده میشوند تا دناتوره شوند.
عیب یابی آزمایش (Trouble shooting)
زمانی که محصول کافی در RT-PCR به دست نیاید، احتمالات زیر را بررسی می کنیم:
1) تجزیه شدن RNA: برای سنتز cDNA باید RNA ما کاملا خالص باشد. بدین منظور باید محصول استخراج RNA خود روی ژل ببریم در صوتی که دو باند واضح از 18s و 28s RNA را دیدیم، نشانگر عدم وجود آلودگی با RNase می باشد.
2) خلوص پایین محصول استخراج RNA: ممکن است نمونه ی RNA آلوده به محلول هایی باشد که هنگام استخراج استفاده کرده ایم مانند SDS، EDTA، نمک های گوانیدین، فسفات و پیروفسفات، پلی آمین ها و اسپریمیدین ها که از سنتز cDNA جلوگیری می کند.
3) کم بودن مقدار نمونه RNA
4) عدم انتخاب درست پرایمر ها برای سنتز cDNA: برای RNA باکتریایی یا RNA های فاقد دم پلیA بهتر است از رندم هگزامر استفاده کنیم. مکمل بودن کامل پرایمر با انتهای 3´در RNA حائز اهمیت زیادی می باشد.
5) نمونه ی RNA غنی از GC باشد: بهتر است دما واکنش سنتز را تا 45 درجه ی سانتی گراد افزایش دهیم.

برای آموزش سنتز cDNA و سایر تکنیک های مورد نیاز برای آزمایشگاه ژنتیک مولکولی
از طریق لینک دوره های آموزشی تخصصی آزمایشگاه می توانید اقدام نمایید.
بیشتر بخوانید:









































