تکنیک کریسپر؛ فناوری ویرایش ژنوم
تکنیک کریسپر (CRISPR) تکنیکی است که امکان اصلاح بسیار خاص و سریع DNA در ژنوم، مجموعه کامل دستورالعمل های ژنتیکی در یک موجود زنده را فراهم می کند. تکنیک کریسپر به عنوان یک سیستم ایمنی اکتسابی در بیشتر باکتری ها و آرکی باکتری ها وجود دارد
تکنیک کریسپر چیست؟ تکنیک کریسپر(CRISPR) یک ابزار قدرتمند برای ویرایش ژنوم است و در دنیای پزشکی سر و صدای زیادی به پا کرده است. تکنیکی سریعتر، ارزانتر و دقیقتر از تکنیکهای قبلی ویرایش DNA است و دارای طیف گستردهای از کاربردهای بالقوه است.
کریسپر چگونه کار می کند؟
پروسه تکنیک کریسپر(CRISPR-Cas9) از دو مولکول کلیدی تشکیل شده است که یک تغییر(جهش) در DNA ایجاد می کند. این دو مولکول شامل:
- یک آنزیم به نام Cas9 که به عنوان یک جفت «قیچی مولکولی» عمل میکند و میتواند دو رشته DNA را در یک مکان خاص در ژنوم برش دهد و برش هایی از DNA اضافه یا حذف می شوند.
- RNA راهنما که gRNA نامیده می شود و شامل یک قطعه کوچک از توالی RNA از پیش طراحی شده (طول حدود 20 باز) است که در یک داربست RNA بلندتر قرار دارد. قسمت داربست به DNA متصل می شود و توالی از پیش طراحی شده Cas9 را به سمت راست ژنوم هدایت می کند. و این اطمینان را حاصل می کند که آنزیم Cas9 در نقطه مناسبی از ژنوم برش می دهد.
تاریخچه تکنیک کریسپر:
معرفی زیست فناوری و مهندسی ژنتیک در سال 1970 عصر جدیدی در حوزه زیست شناسی گشود. این تکنیک برای نخستین بار برای پژوهشگران علوم زیستی این امکان را فراهم کرد تا مولکول DNA را به منظور ابداع راهکارهای درمانی جدید دستکاری نمایند.
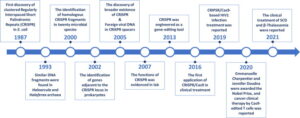
در سال 1987، توالی DNA خاصی در ناحیه غیر کد کننده ژن آلکالین فسفاتاز اشریشیا کلی به عنوان یک توالی تکراری ۲۹ نوکلئوتیدی با فاصله ۳۲ نوکلئوتیدی توسط یوشیزومی ایشی نو ژاپنی مطرح شد. این توالی از چند قطعه DNA تکراری در پشت سر هم تشکیل شده است. در سال 2002، این توالی DNA تکرارهای کوتاه با فواصل منظم نامگذاری شد و نام آن بعداً به تکرارهای پالیندرومی با فاصله منظم خوشه ای (CRISPR) تغییر یافت.
در سال 2005، مشخص شد که توالی های فاصلهدار CRISPR، بسیار همولوگ با توالی های DNA ویروس ها یا پلاسمید های خارجی هستند، که نشان میدهد CRISPR ممکن است به طور خاص در برابر عفونت توسط یک ماده ژنتیکی خارجی عمل کند. در سال 2007، Barrangou و همکارانش. دریافتند که تغییر مصنوعی تکرارها در CRISPR می تواند توانایی ایمنی استرپتوکوکوس ترموفیلوس را نسبت به فاژ خاص تنظیم کند. از طریق آزمایش ها، تکنیک کریسپر (CRISPR-Cas) به طور خاص قطعات ژنی برون زا را که یک «حافظه ایمنی» را تشکیل میدهند، شناسایی و به دست آورد.
هنگامی که باکتری دوباره با همان فاژ آلوده میشود، تکنیک کریسپر (سیستم CRISPR-Cas) ژنهای اگزوژن را از بین میبرد و باکتریها را قادر میسازد تا به این فاژ مقاومت کنند. در سال 2012، جینک و همکارانش. دریافتند که یک RNA تک راهنما در تکنیک کریسپر (CRISPR-Cas) قادر به هدف قرار دادن قطعات خاص DNA است و پیشنهاد کرد که این سیستم می تواند در ویرایش ژن استفاده شود.
در سال 2013، Cong و همکارانش با موفقیت از سیستم CRISPR-Cas در ویرایش ژن هدفمند ژنوم حیوانات استفاده کرد. از آن زمان، نسل سوم فناوری ویرایش ژن CRISPR-Cas یا همان تکنیک کریسپر معرفی شد و به دلیل مزایای فنی آن به طور گسترده در زمینه های مختلف زیست شناسی مولکولی مورد استفاده قرار گرفت. سیستمهای تکرار پالیندرومیک کوتاه (CRISPR)-Cas در حال حاضر در کانون توجه تحقیقات فعال در زیست شناسی قرار دارند.
تکنیک کریسپر (سیستم CRISPR-Cas9) شامل پروتئین های خانواده ژن Cas و آرایه CRISPR متشکل از تکرارها، فاصله ها و توالی رهبر است. دنباله رهبر در بالادست آرایه CRISPR قرار دارد و مسئول شروع رونویسی CRISPR است.
تکرارها توالی های کوتاه تکراری هستند که طول آن ها 21 تا 48 نوکلئوتید است و میتواند یک hair loop را تشکیل دهد و تعداد تکرارها بسته به گونه ها متفاوت است و معمولاً از چند تا چند صد مورد متغیر است. فاصلهگذارها تقریباً 26-72 نوکلئوتید هستند و بین دو تکرار قرار دارند. توالی کد کننده ژن Cas معمولاً در ناحیه بالادست آرایه CRISPR قرار دارد و می تواند پروتئین Cas مربوط به اسید نوکلئیک بسیار حفاظت شده را رمزگذاری کند که دارای یک نوکلئاز، هلیکاز و نیکاز و سایر فعالیت ها است و می تواند به طور خاص شکاف دهد.
اهداف تکنیک کریسپر:
ارائه یک راهکار با ارزش و کارآمد در ویرایش هدفمند ژنوم سلول های زنده یکی از مهمترین اهداف محققان زیستی در سال های اخیر بوده است. اولین مرحله اساسی برای تغییر هدفمند ژنوم، ایجاد یک شکسته دو رشته (DSB) در مکان مورد نظر می باشد که عموما توسط یک آنزیم نوکلئاز انجام می شود. CRISPR/Cas9 سیستمی متشکل از یک پروتئین نوکلئاز (Cas9) متصل به RNA (CRISPR/Cas9) است که بوسیله باکتری ها و آرکی باکتری ها برای جلوگیری از تهاجم عوامل ژنتیکی بیگانه ( مانند ویروس ها و باکتری ها) مورد استفاده قرار می گیرد.
امروزه این سیستم به عنوان یک ابزار قدرتمند جهت دستکاری ژنوم با اهداف درمانی استفاده می شود. مولکول RNA موجود در سیستم CRISPR/Cas9باکتری، ترادفی از چند توالی تکراری کوتاه است که با اتصال به مولکول DNA خارجی، امکان تجزیه آن را توسط Cas9 فراهم می کند. جایگزینی RNA موجود در CRISPR/Cas9 با یک مولکول RNA هدفمند و انتقال آن به سلول، امکان ویرایش ژنوم سلول زنده ،فراهم می شود.
ژن درمانی یک هدف طولانی مدت برای دانشمندان بوده است و روش ها و ابزارهای بهینه زیادی برای اصلاح جهش های بیماری زا در انسان وجود دارد. اخیراً، فناوری تکرارهای کوتاه پالیندرومیک خوشهای بهطور منظم بینفاصله (CRISPR) بهتدریج برای ارزیابی درمان بیماریهای انسانی، از جمله تالاسمی، بیماری پارکینسون، فیبروز کیستیک، گلوکوم، بیماری هانتینگتون، و ویروس نقص ایمنی انسانی (Human Immunodeficiency Virus/Acquired Syndrome/Human Deficiency Immunodeficiency) اخیراً استفاده شده است.
توالی CRISPR متعلق به سیستم ایمنی باکتریایی است که شامل آنزیم نوکلئاز Cas و یک توالی RNA است. توالی RNA منحصر به فرد و مخصوص پاتوژن است و DNA ویروس های مهاجم را شناسایی کرده و به آن متصل می شود و به آنزیم نوکلئاز Cas اجازه می دهد DNA شناسایی شده را قطع کند و ویروس های مهاجم را از بین ببرد.
این ویژگی امکان ویرایش جهش در توالی DNA سلول های زنده را با جایگزینی یک توالی RNA هدفمند خاص با توالی RNA در سیستم CRISPR فراهم می کند. مطالعات قبلی مراحل بهبود در مقابله با بیماری های انسانی ناشی از جهش های تک نوکلئوتیدی را با استفاده از این سیستم گزارش کرده اند.
در بیشتر موارد RNA راهنما از یک توالی خاص از 20 باز تشکیل شده است. اینها مکمل توالی هدف در ژنی هستند که باید ویرایش شوند. با این حال، برای اینکه RNA راهنما قادر به اتصال باشد، لازم نیست همه 20 باز مطابقت داشته باشند.
مشکل این است که توالی با، برای مثال، 19 از 20 پایگاه مکمل ممکن است در جایی کاملاً متفاوت در ژنوم وجود داشته باشد. این به این معنی است که پتانسیل RNA راهنما وجود دارد که به جای یا و همچنین در توالی هدف به آنجا متصل شود. سپس آنزیم Cas9 در محل اشتباه بریده می شود و در نهایت یک جهش را در مکان اشتباه ایجاد می کند. در حالی که این جهش ممکن است اصلاً برای فرد مهم نباشد، می تواند بر یک ژن حیاتی یا بخش مهم دیگری از ژنوم تأثیر بگذارد.
دانشمندان مشتاق یافتن راهی برای اطمینان از اتصال و برش دقیق CRISPR-Cas9 هستند.
دو راه برای دستیابی به این امر عبارتند از:
- طراحی RNA های راهنمای بهتر و خاص تر با استفاده از دانش ما از توالی DNA ژنوم و رفتار “خارج از هدف” نسخه های مختلف مجتمع Cas9-gRNA.
- استفاده از آنزیم Cas9 که تنها یک رشته از DNA هدف را به جای دو رشته قطع می کند. این بدان معناست که دو آنزیم Cas9 و دو RNA راهنما باید در یک مکان باشند تا برش ایجاد شود. این امر احتمال ایجاد برش در محل نامناسب را کاهش می دهد.
کاربردهای تکنیک کریسپر:
تکنیک کریسپر (CRISPR-Cas 9 ) به عنوان یک ابزار قدرتمند برای دست ورزی هدفمند ژنوم از پتانسیل بسیار بالایی در تحقیقات پایه و بالینی برخوردار است. یکی دیگر از دلایل محبوبیت تکنیک کریسپر این است که امکان انجام مهندسی ژنتیک در مقیاس زیاد با هزینه بسیار کم را فراهم می کند.
تفاوت تکنیک کریسپر با دیگر تکنیک های مهندسی ژنتیک این است که امکان معرفی یا حذف بیش از یک ژن در یک زمان را ایجاد می کند. این امکان دستکاری ژن های مختلف را در یک رده سلولی، گیاهی یا حیوانی بسیار سریع فراهم میکند و این فرآیند را از چند سال به چند هفته کاهش میدهد. همچنین تفاوت آن از جهت دیگر این است که خاص گونه نیست، بنابراین می تواند بر روی ارگانیسم هایی که قبلاً به مهندسی ژنتیک مقاوم بوده اند نیز استفاده شود.
ازجمله مهمترین زمینه های تحقیقاتی که می تواند از این ابزار (تکنیک کریسپر) بهره مند شوند می توان به مدلسازی بیماری ها در سلول، ایجاد میزبان های بیانی دست ورزی شده برای تولید مؤثر پروتئین های نوترکیب و طراحی راهکارهای درمانی برای بیماری های ژنتیکی دارای موتاسیون های شناخته شده اشاره نمود. و همچنین در زمینه سلامت می تواند راه را برای توسعه درمان های جدید برای اختلالات متابولیک نادر و بیماری های ژنتیکی از هموفیلی تا بیماری هانتینگتون هموار کند. یکی از، مهمترین چالشهای تکنیک کریسپر در سطح تحقیقات و درمان، شناسایی و کاهش برش های نابجا در این سیستم است.
مکانیسم عمل کریسپر
واژه “CRISPR” مخفف “CRISPR-Cas9” است. CRISPR ها بخش های تخصصی DNA هستند و پروتئین Cas9 (جایی که Cas مخفف “CRISPR-associated” است) آنزیمی است که مانند یک جفت قیچی مولکولی عمل می کند و قادر به برش رشته های DNA است.
مکانیسم عمل روش کریسپر (CRISPR) شامل سه مرحله است: اکتساب، بیان و تداخل. مرحله اول عمدتاً توسط مجموعه پروتئینهای Cas1 و Cas2 انجام میشود، که در تمام سیستمهای شناخته شده CRISPR-Cas مشترک هستند و گاهی اوقات شامل پروتئینهای Cas اضافی نیز میشوند. کمپلکس پروتئینی، موتیف مجاور پروتوسپیسر (protospacer ) و پروتوسپیسر (PAM) را در اسیدهای نوکلئیک خارجی تشخیص می دهد که به صورت جهت دار گرفته می شوند و به عنوان توالی های فاصله دار جدید CRISPR در یک آرایه CRISPR جدا شده با توالی های تکراری ادغام می شوند، بنابراین یک “حافظه ایمنی” از عناصر ژنتیکی مهاجم ایجاد می کنند.
هنگامی که همان ژن اگزوژن مجدداً آلوده می شود، مکان CRISPR به رونوشت پیش ساز CRISPR RNA (pre-crRNA) رونویسی می شود، سپس با کمک ریبونوکلئاز (RNase III) III به یک crRNA بالغ کوچک پردازش می شود. crRNA حاوی توالیهای جداکننده جزئی CRISPR است که به تکرار جزئی CRISPR پیوستهاند.
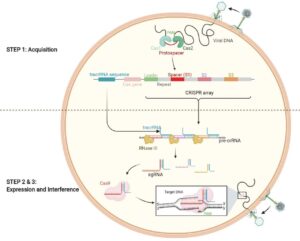
CRISPR locus همچنین یک crRNA فعال کننده ترانس (tracrRNA) را کد می کند که مکمل مناطق تکرار crRNA است. علاوه بر آرایه CRISPR ، یک یا چند نوکلئاز Cas توسط CRISPR locus کدگذاری می شود. به عنوان مثال، در یک سیستم CRISPR-Cas9 نوع II، مهمترین ویژگی یک پروتئین مولکولی بزرگ Cas9 است که در بلوغ crRNA شرکت می کند و اسیدهای نوکلئیک خارجی مهاجم را تجزیه می کند.
ترکیب crRNA با tracrRNA RNA راهنما (sgRNA) را تولید می کند که Cas9 را کمپلکس می کند. متعاقباً، sgRNA به Cas9 متصل می شود تا یک کمپلکس ریبونوکلئوپروتئینی مؤثر را تشکیل دهد که مسئول تخریب اسیدهای نوکلئیک مهاجم است که به طور مناسب از یک توالی PAM مورد نیاز 5′-NGG-3′ فاصله دارند.
PAM برای شناسایی، برش، و تمایز بین DNA خود و غیر خود ضروری است.
در پروتئین Cas9 دو دومین نوکلئازی با نام های، RuvC و HNH وجود دارد که هر کدام با برش یک رشته از DNA شکست های دو رشته با انتهای صاف ایجاد می کنند. به این صورت که دومین HNH رشته مکمل DNA هدف را در موقعیت سه نوکلئوتید بالادست توالی PAM می شکافد، در حالی که دومین RuvC رشته غیر مکمل دیگر را در همان مکان می شکافد و در نهایت منجر ایجاد دو رشته DNA شکست های دو رشته با انتهای صاف می شوند.
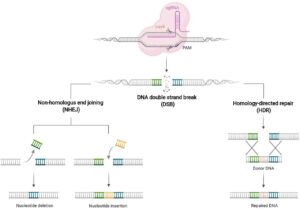
سلول های یوکاریوتی مکانیسمهای ترمیم آسیب DNA را آغاز می کنند، که برجسته ترین آنها اتصال انتهایی غیرهمولوگ (NHEJ) و تعمیر همسان شناختی (HDR) است که میتواند شکاف های شکست دو رشته ای را برای دستیابی به ویرایش هدفمند ژنی ترمیم کند.
NHEJ یک مکانیسم مستعد خطا است که دو سر یک DSB را با درجها یا حذف های کوچک نوکلئوتیدی به طور تصادفی و مکرر به هم میپیوندد و منجر به جهش ها و حذف های تغییر چارچوب می شود که به نوبه خود منجر به حذف ژن هدفمند می شود. در مقابل، HDR میتواند به ویرایش دقیق ژنهای هدف دست یابد، که امکان درج یا جایگزینی یک توالی نوکلئوتیدی خاص را در حضور الگوهای اهداکننده همولوگ اگزوژن فراهم میکند. با این حال، هدفگیری ژن با واسطه HDR به دلیل کارایی کم خود به خودی HDR و محدودیتهای تحویل الگوی اهداکننده در سلول ها چالش برانگیز است.
سیستمهای متنوع CRISPR به طور مداوم در طبیعت شناسایی میشوند و تعداد زیادی از فناوریهای مشتق شده با واسطه CRISPR-Cas به طور مصنوعی ایجاد میشوند. جعبه ابزار ویرایش ژنتیکی پایه CRISPR به سرعت در حال گسترش است. چندین تکنیک کریسپر (CRISPR) به عنوان ابزار ویرایش ژن کارآمد برای DNA یا RNA توسعه یافته و در بسیاری از زمینه ها اعمال شده است.
تکنیک کریسپر یک روش درمانی با استفاده از دستکاری ژنتیکی است وبه همین دلیل شبه های اخلاقی بسیاری در این زمینه به وجود آید که پاسخ به آنها کار راحتی نخواهد بود؛ البته به علت وجود فواید بسیار زیاد و همچنین کمک شایانی که این روش درمانی به بهبود سطح سلامت انسان می کند می توان از این سوالات چشم پوشی کرد.
سیستم های جدید و ابزارهای مشتق شده از تکنیک کریسپر
سیستمهای CRISPR تقریباً در 45 درصد از باکتریها و 85 درصد از آرکی باکتری ها یافت میشوند و در آخرین طبقهبندی به دو دسته تقسیم میشوند. افکتورهای (اندام یا سلولی که در پاسخ به یک محرک عمل می کند.)کلاس 1 از کمپلکس های چند پروتئینی، از جمله نوع I، نوع III و به ندرت، نوع IV استفاده می کنند، در حالی که افکتورهای کلاس 2 به پروتئین های موثر تک جزئی برای مختل کردن ژن های هدف ارائه شده توسط Cas9، از جمله انواع II، V، و VI متکی هستند.
CRISPR-Cas9 متعلق به نوع II در دسته دوم نمونه های اثرگذار تک پروتئینی است و در حال حاضر پرکاربردترین و کاملترین ابزار ویرایش ژنوم است. سیستم های چندگانه نوع II به عنوان ابزار ویرایش ژن کارآمد برای DNA یا RNA توسعه یافته اند و برای حیوانات، گیاهان و میکروارگانیسم ها اعمال می شوند.
استرپتوکوکوس پیوژنز
در سال 2013، استرپتوکوکوس پیوژنز Cas9 (SpCas9) برای اولین بار برای ویرایش ژنوم در سلول های پستانداران استفاده شد و همچنان پرکاربردترین Cas9 است. شناسایی PAM 5′-NGG در دسترس بودن سایت های هدف SpCas9 را برای ویرایش ژن محدود می کند. برای گسترش فضای ویرایش ژنوم CRISPR و بهبود ویژگی هدفگیری، سیستم های CRISPR باید از گونه های میکروبی جدیدی که ممکن است نیازمندی های PAM متفاوتی داشته باشند، شناسایی شوند.
رویکرد دیگر مهندسی ویژگی های Cas9 PAM از طریق جهش های هدایت شده توسط ساختار و تکامل هدایت شده است. این تلاشها منجر به ایجاد پروتئینهای Cas9 با وزن مولکولی کوچک و توانایی تشخیص بیشتر توالیهای PAM شده است. به عنوان مثال، استرپتوکوکوس ترموفیلوس Cas9 PAM 5′-NNAGAAW را تشخیص می دهد (W نشان دهنده A یا T است).
Neisseria meningitidis Cas9 5′-NNNNGATT را تشخیص می دهد. نوع گسترش یافته-PAM SpCas9، SpRY، 5′-NRN و 5′-NYN را تشخیص می دهد (R نشان دهنده A یا C؛ Y نشان دهنده C یا T)، که می تواند تقریباً تمام PAM ها را هدف قرار دهد و ممکن است مسیری را به سمت توسعه هموار کند. فن آوری های ویرایشی که دیگر محدود به محدودیت های هدف گذاری ذاتی نیستند.
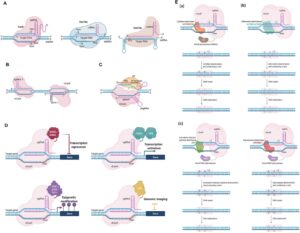
CRISPR/nCas9 و CRISPR/dCas9
همانطور که در بالا توضیح دادیم، پروتئین Cas9 دارای دو دومین RuvC و HNH است که عملکرد برش را انجام می دهند. اگر یک جهش باز منفرد (D10A یا H840A) به یکی از دامنه ها وارد شود، Cas9 به نیکاز Cas9 (nCas9) تبدیل می شود، که تنها می تواند یک رشته را در یک توالی DNA هدف بشکند. اگر دو حوزه به طور همزمان جهش پیدا کنند، Cas9 به Cas9 کمبود هسته (dCas9) تبدیل می شود که به طور کامل فعالیت اندونوکلئاز را از دست می دهد. nCas9 و dCas9 مزایای قابل توجهی را در زمینههای مدولاسیون رونویسی، اصلاح اپی ژنتیکی و تصویربرداری ژنومی ارائه کردهاند.
nCas9 اغلب در ترکیب با دو sgRNA مختلف برای هدف قرار دادن همزمان دو رشته منفرد از یک ژن مورد نظر استفاده می شود. این رویکرد می تواند به طور قابل توجهی اثرات خارج از هدف سیستم های CRISPR-Cas9 را کاهش دهد و تا حد زیادی ویژگی ویرایش ژن را بهبود بخشد. nCas9 می تواند برای جایگزینی قطعات ژنی بزرگ و بهبود احتمال ترمیم نوترکیبی همولوگ استفاده شود.
اگرچه dCas9 فعالیت نوکلئازی را از دست میدهد، اما همچنان فعالیت اتصال به DNA را حفظ میکند و همچنان میتواند توالیهای DNA را به روشی قابل برنامهریزی توسط gRNA هدف قرار داده و به آن متصل شود. dCas9 رونویسی را با ترکیب فعالکنندهها یا سرکوبگرهای رونویسی و تعدیل بیان ژن بدون وارد کردن جهشهای برگشتناپذیر به ژنوم تنظیم میکند. روشهایی که از dCas9 برای این منظور استفاده میکنند معمولاً به عنوان فعالسازی CRISPR (CRISPRa) و تداخل CRISPR (CRISPRi) نامیده میشوند. CRISPRi رونویسی را از طریق کمک کمپلکسهای dCas-sgRNA که بهطور فضایی RNA پلیمراز را مسدود میکنند، مهار میکند. CRISPri نسبت به فناوری سنتی RNAi سطح قابل توجهی بالاتری از خاموش کردن ژن دارد.
CRISPRi با مهار رونویسی رخ می دهد، در حالی که RNAi mRNA ها را در سیتوپلاسم تجزیه می کند. قابل ذکر است، CRISPRi برای سرکوب ژن در باکتری ها کافی است و بازدارنده های کمکی برای ترکیب آن با dCas برای دامنه های سرکوب کننده رونویسی اصلاح کننده کروماتین در سلول های یوکاریوتی، مانند دامنه های KRAB و SRDX لازم هستند. CRISPRa بر ادغام dCas9 به تکرارهای متعدد حوزههای فعالسازی رونویسی، مانند VP64، VPR، p65AD، VP16، و VP160 تکیه میکند تا رونویسی را در سایت های هدف افزایش دهد.
dCas9 را می توان برای اصلاح اپی ژنتیک و تصویربرداری ژنومی به کار برد. dCas9 با عوامل اپی ژنتیکی، مانند هیستون دمتیلاز LSD1، هیستون استیل ترانسفراز p300، و پروتئین های TET ترکیب می شود تا علائم اپی ژنتیکی را در DNA یا اهداف هیستونی تغییر دهد. این رویکرد می تواند وضعیت اصلاح کروماتین را تغییر دهد و بیان ژن، تمایز سلولی و سایر فرآیندهای بیولوژیکی را تنظیم کند.
dCas9 با پروتئینهای نشاندار شده با فلورسنت، مانند GFP، ترکیب میشود و میتواند در تجسم جایگاههای DNA حاوی توالیهای مکرر و برچسبگذاری سانترومرهای درونزا، مناطق دور مرکزی، و تلومرها با sgRNA تک یا چندگانه استفاده شود. این رویکرد یک سیستم تصویربرداری اختصاصی sgRNA را ایجاد میکند و به تجسم جایگاه ژنومی در سلولهای زنده در زمان واقعی دست مییابد.
آینده تکنیک کریسپر (CRISPR-Cas9)
احتمالاً سال ها طول می کشد تا تکنیک کریسپر (CRISPR-Cas9) به طور معمول در انسان استفاده شود. تحقیقات زیادی هنوز بر روی استفاده از آن در مدل های حیوانی یا سلول های جدا شده انسانی متمرکز است، با این هدف که در نهایت از این فناوری برای درمان معمول بیماری ها در انسان استفاده شود. کارهای زیادی روی حذف اثرات «خارج از هدف» متمرکز است، جایی که تکنیک کریسپر CRISPR-Cas9 ژن متفاوتی را با ژنی که قرار بود ویرایش شود کاهش میدهد.
مزایا و معایب:
تکنیک کریسپر (CRISPR/Cas9) به دلیل انعطاف پذیری و دقت بالای آن در برش و چسباندن DNA از محبوبیت ویژه ای برخوردار است، به این معنی که به محققان اجازه می دهد تا به راحتی توالی DNA را تغییر دهند و عملکرد ژن را اصلاح کنند. تکنیک کریسپر کاربردهای بالقوه زیادی دارد، از جمله اصلاح نقایص ژنتیکی، درمان و پیشگیری از گسترش بیماری ها و بهبود رشد و انعطاف پذیری محصولات. با این حال، این فناوری نگرانی های اخلاقی را نیز ایجاد میکند.
این سیستم یک تکنولوژی مهندسی ژنوم همچنین با قابلیت تطبیق بسیار بالا در شرایط مختلف آزمایشگاهی و در سطح سلول های یوکاریوتی است. در واقع تکنیک کریسپر (CRISPR/Cas9) یک فناوری منحصر به فرد است که ژنتیک دانان و محققان پزشکی را قادر می سازد تا بخش هایی از ژنوم را با حذف، افزودن یا تغییر بخش هایی از توالی DNA ویرایش کنند.
بیشتر بخوانید:








































