کاربرد تکنیک MLPA در تشخیص بیماری های ژنتیکی و بررسی واریانت های آن
تکنیک MLPA با نام (Multiplex Ligation-dependent Probe Amplification)، یک تکنیک مولکولی ساده، قدرتمند و پرکاربرد در زمینه بررسی بیماری های ژنتیکی است که نوعی multiplex PCR می باشد. تکنیک MLPA امکان سنجش کمی توالی های نوکلئیک اسیدی را بسیار سریع و با کارایی بالا فراهم می کند که در سال ۲۰۰۲ توسط MRC-Holland معرفی و ارائه گردید.
تکنیک MLPA توانایی افتراق بین توالی هایی که تنها در یک نوکلئوتید با یکدیگر متفاوت اند را دارد. این تکنیک جهت تشخیص تعداد کپی های غیرعادی ژن ها (copy number) هم چون جهش های حذف و مضاعف شدن، تعیین وضعیت متیلاسیون DNA، تعیین SNPها و جهش های نقطه ای و بررسی کمی mRNA به کار می رود؛ به گونه ای که قادر است بیش از ۵۰ نوع توالی DNA یا RNA ژنومی را به طور همزمان آنالیز و بررسی کند. انتظار می رود که، تکنیک MLPA در آینده ای نه چندان دور به تکنیکی مهم و پرکاربرد در آنالیز مولکولی اختلالات ژنتیکی و تایید و تشخیص آزمایشگاهی آنها تبدیل شود.
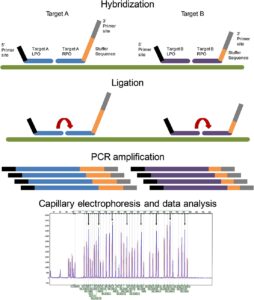
برای رسیدن به آن چه گفته شد پنج مرحله زیر باید انجام گیرد:
1)دناتوراسیون DNA و هیبریداسیون پروبهای MLPA:
در این مرحله، DNA دناتوره شده و به طور overnight با مخلوطی از پروب های MLPA انکوبه می گردد. هر پروب MLPA شامل دو الیگونوکلئوتید مجزا از هم می باشد که half-probe (5′ and 3′ half-probes) گفته می شوند. هر یک از پروبها، دارای یکی از توالی های متصل شونده به پرایمر و توالی اختصاصی هدف هستند. توالی های هدف به طور معمول اگزونی خاص در ژن موردنظر می باشند. تمام پروب های مختلف مورداستفاده در یک واکنش MLPA، توالی یکسانی جهت اتصال پرایمر دارند، که مالتیپلکس کردن واکنش و تکثیر همزمان کل پروب ها را امکان پذیر می سازد.
در حین هیبریداسیون، DNA الگو با این پروب ها هیبرید شده و دو الیگونوکلئوتید مربوط به پروب، دقیقا در کنار هم روی یک رشته، به توالی هدف متصل می شوند. یکی از دو نیم پروب مورداستفاده و یا هر دوی آنها، دارای توالی Stuffer هستند که در نواحی هدف گوناگون، دارای طول متفاوتی است. همین موضوع باعث می شود که multiplexing امکان پذیر شود و هم چنین محصولات تولیدشده هنگام الکتروفورز از یکدیگر متمایز شوند. از آن جایی که MLPA تکنیکی مالتیپلکس است، می توان آنالیز هر نمونه را به طور همزمان با بیش از ۶۰ پروب انجام داد و چندین ناحیه را مورد هدف قرار داد.
2) واکنش Ligation:
در مرحله (ligation) دو پرایمر به هم متصل میشوند. واکنش ligation فقط زمانی تحت تاثیر آنزیم DNA لیگاز می تواند انجام شود که هر دو پروب الیگونوکلئوتیدی به توالیهایی مجاور هم هیبرید شده باشند.
لیگاز ligase-65 که آنزیمی وابسته به NAD می باشد برای این منظور استفاده می شود. سؤالی که در این جا پیش می آید این است که اگر هدف اتصال پروب ها به یکدیگر است، چرا از همان اول از دو پروب جداگانه استفاده میشود؟ هر دو پروب جایگاه هایی برای متصل شدن به پرایمر دارند. پس اگر این پروب ها از اول مولکول هایی یکسان بودند، حتی در صورت نبود DNA هدف هم تکثیر می شدند و تکثیر غیراختصاصی انجام می شد.
آنزیم لیگاز به شدت اختصاصی عمل میکند. در صورت وجود کوچکترین mismatch میان پروب و توالی هدف، لیگاز توانایی اتصال پروب ها را ندارد و تکثیر انجام نخواهد شد. درنتیجه، MLPA قدرت تشخیص جهش های نقطه ای را داشته و حتی ژن های هدف واقعی و سودوژن ها را از هم جدا می کند.
3) واکنش PCR:
دراین مرحله از آنزیم پلیمراز، dNTPها و پرایمرهای forward و reverse استفاده می شود. تکثیر نمایی تنها در مورد پروبهایی رخ می دهد که به وسیله ی پیوند کووالانسی به هم متصل شده باشند (واکنش ligation). از آنجایی که تمام پروبها توالی مشترکی جهت اتصال به پرایمر دارند، بر خلاف multiplex PCR استاندارد، در MLPA تنها یک جفت پرایمر استفاده می شود.
درنتیجه اضافه کردن فقط یک مجموعه پرایمری برای مطالعه تمامی توالیهای هدف کافی است و تکنیک MLPA محدودیتهای رایج ناشی از این موضوع که در multiplex PCR استاندرد وجود دارد، را ندارد. از آن جایی که مقدار محصول تولید شده با PCR، نسبت مستقیم با مقدار DNA هدف اولیه موجود در نمونه دارد، تعداد محصولاتی که از پروبهای متصلشده ایجاد میشوند، معیاری برای سنجش تعداد توالی های هدف موجود در نمونه است. پرایمر forward با مواد فلورسنت لیبل میشود تا بررسیهای کمی و مشاهده نتایج طی آنالیز امکان پذیر شود.
4)تفکیک محصولات تکثیر از یکدیگر به کمک الکتروفورز مویرگی:
در این مرحله محصولات حاصل از تکثیر به وسیله ی الکتروفورز مویرگی در ژل دناتورهکننده بر اساس اندازه از هم تفکیک شده و تفاوت طول ها به صورت الگویی از پیک ها که الکتروفروگرام گفته می شود، نشان داده می شود. امپلیکون ها دارای طول هایی معین و متفاوت هستند که به خاطر توالی stuffer موجود در هر پروب خاص ایجاد می شود و آنالیز کمی را امکان پذیر می سازد.
5) آنالیز دادهها:
پروب های الیگونوکلئوتیدی که به یکدیگر متصل نشده باشند، فقط یکی از پرایمرها را دارند. درنتیجه به جای تکثیر نمایی، این پروب ها به صورت خطی تکثیر شده و سیگنالی ایجاد نخواهند کرد. به همین دلیل، جداسازی و از بین بردن پروب های متصل نشده در MLPA لزومی ندارد و همین موضوع موجب می شود استفاده از آن آسان گردد.
با نرمالیزاسیون مقایسه هر نمونه با مجموعه ای از نمونه های مرجع، می توان probe ratio را به دست آورد که مقدار DNA هدف موجود در نمونه را به طور نسبی مشخص می کند. این نسبت، تعداد کپی های موجود از هر ژن را مشخص می کند. کیفیت واکنش با تعیین پیک های کنترل ارزیابی می شود و اطلاعاتی را در مورد کارایی واکنش به ما می دهد.
از آن جایی که ژن های انسانی دیپلوئید هستند، در صورتیکه دو نسخه در نمونه موجود باشد، نسبت 1 خواهد بود. معنی این نسبت آن است که پروب های موجود در نمونه باعث ایجاد تعداد ژن های یکسانی با نمونه مرجع شده اند. اگر نسبت، 0/5 باشد، فقط یک نسخه از ژن در فرد وجود دارد که احتمالا به معنی حذف هتروزیگوتی ژن هدف است.
برعکس، اگر نسبت 1/5 باشد، ممکن است مضاعف شدگی هتروزیگوتی رخ داده باشد. حذف های هموزیگوتی به راحتی با تشخیص حضور یا عدم حضور پیک هایی خاص در ژن هدف، در صورت تکثیر نرمال پروب های کنترل مشخص می شوند. از طرف دیگر حذف های هتروزیگوتی و مضاعف شدگی ها پیک هایی با ارتفاع یا مکان قرارگیری متفاوت ایجاد میکنند.
واکنش های PCR با کارایی متفاوت در پروب ها و نمونه های مختلف، آنالیز نتایج را با چالش هایی رو به رو خواهد کرد، از این رو نرم افزارهای مختلفی جهت آنالیز دادههای MLPA توسعه پیدا کردهاند تا از داده های خام واکنش تفسیر درست تری برداشت شود. درنتیجه استراتژی های مختلفی به منظور آنالیز داده های MLPA توسعه پیدا کرده اند تا از داده های خام واکنش تفسیر درست تری برداشت شود. یکی از نرم افزارهای پر کاربرد، Coffalyser است که برنامهای بر پایه excel بوده و تمام مراحل نرمالیزاسیون دادهها و اصلاح دادههای sloping را انجام میدهد.
واریانت های تکنیک MLPA (RT-MLPA و MS-MLPA)
یکی از این واریانت ها،تکنیک RT-MLPA است که میتواند جهت تهیه پروفایل mRNAها استفاده شود. آنزیم لیگاز نمی تواند پروبهایی را متصل کند که به مولکول RNA متصل شدهاند. به همین خاطر، واکنش RT-MLPA با رونوشتبرداری معکوس mRNA و تبدیل آن به cDNA انجام می پذیرد. بعد از این مرحله، سایر واکنش مثل واکنش MLPA عادی انجام میشود.
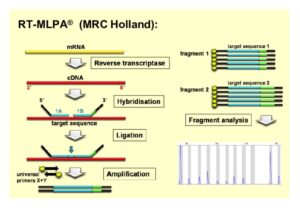
واریانت دیگر، MS-MLPA (Methylation-Specific MLPA) است که به جهت تعیین کمی تعداد کپی ها و هم چنین تهیه پروفایل متیلاسیون انجام می شود. این روش در تشخیص بیماری های مربوط به حکگذاری و همچنین آنالیز نقایص مربوط به متیلاسیون در نمونههای توموری بسیار مفید است و کاربرد دارد.
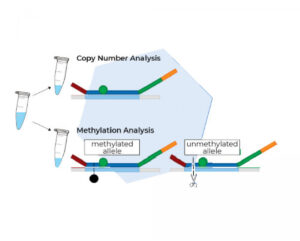 تکنیک MS-MLPA
تکنیک MS-MLPA
تکنیک Methylation-specific MLPA (MS-MLPA) متدی نیمه-کمی به منظور تهیه پروفایل متیلاسیون می باشد. در این تکنیک، با استفاده از آنزیم محدودکننده حساس به متیلاسیون تعداد کپی در ترکیب تعیین می شود. امروزه از تکنیک MS-MLPA برای تعیین تغییرات اپی ژنتیکی به کار می رود. یکی از مهم ترین کاربردهای این تکنیک تشخیص بیماری های وابسته به حکگذاری ژنومی همچون بیماری پرادرویلی، آنجلمن، سندروم بکویت ویدمن و … می باشد.
تکنیک MS-MLPA به صورت گستردهای در آنالیز تومورها و بررسی غیرفعال شدن ژنهای سرکوبکننده تومور در زمان رونویسی، که ممکن است باعث پیشرفت تومور و مقاومت به داروهای شیمیدرمانی شود، کاربرد دارد. تشخیص نقصهای موجود در الگوی متیلاسیون میتواند جهت آنالیز دقیقتر نوع تومور استفاده شود. پروتکل MS-MLPA بسیار شبیه روش استاندارد MLPA است. آن چه این دو را از هم متفاوت می کند این است که در هر واکنش MS-MLPA دو نمونه ایجاد می شود:
a. نمونه تجزیه نشده جهت تعیین تعداد کپی
b. نمونه تجزیه شده جهت تشخیص متیلاسیون. فرایند MS-MLPA پنج مرحله دارد:
پروتکل MS-MLPA
1.دناتوراسیون DNA و هیبریداسیون پروب های MLPA
2.واکنش ligation و تجزیه توسط آنزیم محدودکننده
3.واکنش PCR
4.تفکیک محصولات تکثیری توسط الکتروفورز مویرگی
5.آنالیز داده ها
پروب های MS-MLPA که برای واکنش های تشخیص متیلاسیون استفاده می شوند، به سایر پروبهای MLPA شبیه هستند، اما توالی هدف آن ها دارای جایگاه تشخیص اندونوکلئاز حساس به متیلاسیون HhaI می باشد. بعد از هیبریداسیون، واکنش به دو لوله جداگانه تقسیم می شود. در یکی از لوله ها، واکنش MLPA استاندارد انجام گرفته و اطلاعاتی را در مورد تغییرات در تعداد کپی ها به ما می دهد.
در لوله دیگر، انکوباسیون با اندونوکلئاز HhaI همزمان با ligation پروبهای هیبریدشده انجام می شود. هیبرید تشکیلشده بین پروب ها و نمونه DNA غیرمتیله به وسیله ی آنزیم محدودکننده HhaI تجزیه می شود. پروب های تجزیه شده توسط PCR به صورت نمایی تکثیر نمی شوند و به همین دلیل در زمان الکتروفورز مویرگی سیگنالی از آن ها به دست نخواهد آمد. در مقابل، درصورتی که نمونه DNA متیله باشد، هیبریدهای پروب-DNA به تجزیه به وسیله ی HhaI مقاوم اند و پروب های ligate شده، بعد از الکتروفورز پیک ایجاد خواهند کرد.










































