شرایط کشت مایع آمنیوتیک، انواع روش های هاروست و آماده سازی نمونه ها
مایع آمنیوتیک مایعی شفاف و تا حدودی زرد رنگ است که اطراف جنین را احاطه می کند. این مایع اطراف جنین را احاطه کرده و موجب شناور شدن آن می گردد. میزان مایع آمنیوتیک در هفته ۳۴ حاملگی به حداکثر میزان خود (حدود ۸۰۰ میلی لیتر) می رسد.
مایع آمنیوتیک بوسیله پلاسمای مادری ایجاد می گردد و در نتیجه فشار اسمزی از دیواره ساک حاملگی به درون آن نفوذ می کند. کلیه جنین در حدود ۱۶ هفتگی شروع به کار می کند بنابراین ادرار جنین نیز به تشکیل مایع کمک می کند.
نحوه جمع آوری و انتقال نمونه به آزمایشگاه
بهتر است که 15-20 میلی لیتر مایع آمنیوتیک در هفته ۱۷_۱۵ حاملگی، بوسیله پزشک متخصص زنان گرفته شود. سرنگ نمونه گیری باید non- toxic باشد. toxic بودن سرنگ یکی از عوامل جواب ندادن(failure) کشت است، بنابراین باید مطمئن باشیم که سرنگ و پیستون هایش non- toxic هستند. مایع در دو لوله پلاستیکی استریل تقسیم می شود که سانتریفوژ شود.
پیشنهاد می شود که انتقال سریع نمونه ها به آزمایشگاه صورت بگیرد و از قرار دادن نمونه در درجه حرارت های بالا، در حین حمل نمونه، اجتناب شود.
ترکیبات موجود در نمونه مایع آمنیوتیک
-
ترکیبات سلولی
در طول مراحل اولیه حاملگی، مایع آمنیوتیک از مقدار زیادی سرم مادری و همچنین محتویات سلول های جنینی، که با افزایش سن جنین، این محتویات سلولی بیشتر می گردد، تشکیل می شود. یک جمعیت ناهمگون از سلول ها وجود دارد که شامل مایع آمنیوتیک، پوست، کانال تغذیه ای(Alimentary) و سیستم تنفسی و سیستم ادراری و تناسلی(Urogenital) است. در مراحل بعدی حاملگی، بیشتر سلول ها قابل رشد یا قابل دوام نیستند اما از سلول های قابل رشد سه دسته سلول های تشکیل دهنده کلنی وجود دارد:
- سلول های آمنیوسیت (AF)
- سلول های اپیتلوئید (E)
- سلول های شبه فیبروبلاست
شرایط نمونه گیری
مایع آمنیوتیک چه رنگی است؟ مایع آمنیوتیک به رنگ زرد کمرنگ است و اغلب در مراحل بعدی حاملگی وقتی غلظت سلول ها بالاتر است، رنگ مایع کدر می شود. ظاهر ادرار می تواند شبیه مایع آمنیوتیک باشد، اگرچه به نظر کمرنگ تر می رسد. در صورتیکه مشکوک باشیم به اینکه آیا نمونه ادرار است یا خیر.
تشخیص بین این دو، با استفاده تست reagent strip برای شناسایی آلبومین امکان پذیر است، که در مایع آمنیوتیک وجود دارد، ولی در ادرار وجود ندارد. نمونه می تواند با خون جنین یا مادر هم آلوده باشد. گرچه سلول های خون مادر قابلیت بالایی برای رشد در مایع آمنیوتیک ندارند، اما تست Kleihauer می تواند برای تشخیص نمونه خون جنین از مادر، اگر لازم است انجام شود.
لخته های خونی هم می تواند وجود داشته باشد که اگر کوچک باشند، می تواند برداشته و دور ریخته شوند. زمانی که لخته های بزرگتر وجود داشته باشند، می توانند با آنزیم شکسته شوند و سلول های مایع آمنیوتیک که در داخل لخته ها محبوس بودند آزاد شوند. گاهی اوقات، نمونه ها می توانند، قهوه ای یا سبز باشند، که علت آن آلودگی با خون همولیز شده کهنه است.
در این حالت، بهتر است، سلول های مایع آمنیوتیک، با محیط کامل قبل از کشت شسته شوند، ولی اغلب رشد آن نسبت به نمونه های معمولی (optimum) ،مدت زمان بیشتری طول می کشد. در صورت وجود لخته خون، می توانیم لخته های خون در نمونه های مایع آمنیوتیک را، پخش آنزیمی کنیم.
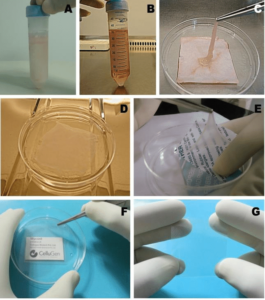
شکستن لخته در مایع آمنیوتیک:
مواد و وسایل:
۱-هود لامینار کلاس 2 (Class 2 microbiological safety cabinet)
۲- بن ماری ۳۷ درجه سانتی گراد
۳- لوله سانتریفوژ 10ml ته مخروطی
۴-پیپت پاستور شیشه ای ۱۵۰mm
۵-محلول Trypsin_Versene (TV) استریل و گرم در ۳۷ درجه سانتی گراد
روش کار
۱- با استفاده از یک پیپت پاستور شیشه ای، لخته را از مایع آمنیوتیک بردارید و آن را در یک لوله سانتریفوژ با 5ml از TV گرم قرار بدهید.
۲- با ضربات و تکان های شدید به لوله، لخته شروع به شکستن می کند.
۳- به مدت ۳۰ دقیقه در بن ماری ۳۷ درجه سانتی گراد قرار بدهید، تا لخته شکسته شود.
۴- وقتی لخته خرد شد، پروتکل را ادامه دهید.
راه اندازی (setting up) – کشت سلولی مایع آمنیوتیک
پیش از ست آپ مایع آمنیوتیک در کشت، مهم است که جزئیات بیمار را چک کنید و به شرایط و حجم نمونه توجه کنید. این جزئیات می توانند روی یک کارت پر شود که بعدا برای ضبط تمام اطلاعات بعدی کشت، مورد استفاده قرار می گیرد.
انواع کشت سلولی مایع آمنیوتیک
۱- کشت های Cover slip (لام)
۲- کشت با فلاسک یا در لوله
پروتکل/دستورالعمل های انجام انواع کشت سلولی مایع آمنیوتیک
راه اندازی کشت مایع آمنیوتیک
a. کشت cover slip (لام)
۱- پتری دیش پلاستیکی
۲- پیپت پاستور پلاستیکی
۳- پنس جراحی نازک (fine forceps)
۴- انکوباتور CO2 دار در ۳۷ درجه سانتی گراد
۵- باکس پلاستیکی
6- cover slips
نحوه انجام کشت های cover slip:
۱- برای انجام کار ابتدا اگر نیاز است، مایع آمنیوتیک را به دو لوله سانتریفوژ مخروطی شکل منتقل کنید، که بر روی لوله ها که مایع آمنیوتیک ریختیم نام بیمار و شماره آزمایشگاه لیبل و با شماره ۱ و۲ مشخص شود. در صورتی که به آزمایش AFP نیاز است، O.5 ml برای این تست نگه دارید.
۲- لوله ها را در RPM(1200-1300) 200g به مدت ۵ دقیقه سانتریفوژ کنید.
۳- سایز پلیت (رسوب) را در هر دو لوله تخمین بزنید و محلول رویی را به یک ظرف نمونه اصلی بریزید. این محلول را برای آنالیز تست های بیوشیمیایی که نیاز است فریز کنید.
۴- پلیت را با تکان دادن آرام، دوباره به حالت محلول در بیارید و 05ml محیط مناسب برای هر کشت اضافه کنید.
در این مرحله: اگر هیچ پلیتی مشاهده نشد – یک ظرف کشت از هر لوله سانتریفوژ بگذارید، پلیت قابل دیدن – دو ظرف کشت هر لوله سانتریفوژ بگذارید و پلیت های بزرگ – دو یا سه ظرف کشت از هر لوله سانتریفوژ بگذارید. در صورت امکان، از محیط های مختلف برای لوله های ۱ و ۲ استفاده شود.
۵- تعداد مشخص از پتری دیش ها را لیبل کنید و forceps استریل به کار ببرید، و یک لامل شیشه ای داخل هر دیش قرار دهید.
۶- با استفاده از یک پیپت پاستور پلاستیکی .05ml سوسپانسیون سلولی را بر روی هر لامل شیشه ای قرار دهید و مراقب باشید که کل سوسپانسیون را به یک cover slip انحصار ندهید. ولیکن، به منظور اطمینان از رشد back-up یک قطره کوچک از سوسپانسیون را روی پتری دیش قرار دهید.
۷- کشت ها را در ۳۷ درجه سانتی گراد در یک انکوباتور CO2 یا ترایپل gass انکوبه کنید. ایده ال است که، یک cover slip از هر لوله سانتریفوژ، در دو انکوبه جداگانه، با منابع گاز جداگانه انکوبه شود.
b. کشت با فلاسک یا در لوله
۱- لوله های یک طرف تخت یا فلاسک های ۲۵ سانتی متر مربع لوله لیتون
۲- انکوباتور ۳۷ درجه (گاز برای کشت های باز، بدون گاز برای کشت های بسته)
۳- سیلندر گاز ۵% CO2 در هوا
نحوه انجام کشت های با لوله یا فلاسک
۱- مراحل ۳-۱ را مثل بالا انجام دهید. اگر لوله هایی که یک طرفشون تخت است استفاده می کنید (لوله لیتون)، نمونه را مستقیما در هر دو لوله تقسیم کرده و مراحل ۳-۱ را ادامه دهید.
۲- پلیت را به آرامی با تکان دادن به حالت معلق (محلول) در بیاورید. به هر لوله کشت، یک میلی لیتر محیط کامل یا مقدار مشخص محیط به هر لوله سانتریفوژ و اگر با فلاسک شروع کردید (3ml به هر لوله) اضافه کنید. سوسپانسیون سلولی را، اگر فلاسک استفاده می شود، به فلاسک منتقل کنید. اگر امکان دارد دو محیط مختلف به کار ببرید.
۳- برای سیستم بسته، محیط با HEPES buffered به کار ببرید. در لوله ها را ببندید و در ۳۷ درجه سانتی گراد انکوبه کنید. برای سیستم بسته محیط با بافر بیکربنات به کار ببرید، 5% CO2 در هوای محیط کشت، در لوله ها را بسته و در ۳۷ درجه سانتی گراد انکوبه کنید. برای سیستم باز، درب لوله ها را به طور کامل بپیچانید و سپس شل کنید با یک پیچ، و در یک انکوباتور گاز دار در ۳۷ درجه سانتی گراد قرار بدهید.
نکته: اگر اختصاصا نمونه کم باشد، نمونه می تواند اول spun down شود و سپس این تست ها بر روی محلول رویی، (supernatant) انجام شود. روش دیگه اینکه از باکس های پلاستیکی که با %5 CO2 درهوا Seal شده استفاده کنید.
بررسی پایداری کشت
کشت های cover slip:
دو روز پس از set up کشت، 1.5ml محیط کشت کامل مخصوص به هر لوله کشت از لبه دیش اضافه کنید، به طوری که کمترین آشفتگی را در سوسپانسیون سلولی original و سلول های تازه چسبیده شده بوجود بیارید، و دوباره به مدت 48h انکوبه کنید. پس از این زمان، کشت ها را زیر میکروسکوپ invert ببینید، اگر رشد کافی وجود داشته باشد، سوسپانسیون سلولی را برای شروع یک کشت back-up جداگانه به کار ببرید، و محیط تازه به کشت original اضافه کنید.
متناوبا اگر رشد کافی وجود داشته باشد، همین روش روز پنجم انجام شود. بعد ازآن کشت ها مرتب امتحان بشوند و محیط کشت روزانه عوض شود. تا زمانی که آن ها برای هاروست آماده شوند ( محیط کشت می تواند یا از طریق یک پمپ به داخل یک ضدعفونی کننده کشیده شده و یا با دقت به داخل یک ظرف شامل ماده ضدعفونی کننده خالی شود).
عمده کشت ها بین ۸-۵ روز هاروست می شوند، اگر چه همیشه چند case با میزان رشد آهسته تر داریم. در صورتی که پس از ۱۰-۷ روز هیچ علامتی ار چسبندگی سلول یا رشد سلول وجود نداشته باشد، کارشناس آزمایشگاه، می تواند نمونه آمنیوسنتز را تکرار کند. چک کنید و کشت های back-up را در حالت رشد آهسته یا حالتی که ذاتا کشت منفی می شود نگه دارید.
کشت های در لوله و فلاسک:
کشت ها را به مدت ۷-۶ روز بدون اینکه بهشون سربزنید رها کنید. بعد رشد سلول ها را با استفاده از یک میکروسکوپ invert ببینید. طبق میزان رشدی که وجود دارد، کشت ها می توانند ته نشین بشوند و یا محیط تازه اضافه شود ( محیط تازه اضافی افزوده شده و یا تعویض کامل محیط انجام می شود). مجددا، سوسپانسیون سلولی برای شروع کشت های back-up
مورد استفاده قرار می گیرد. کشت ها را به مدت ۳-۲ روز به حال خود رها کنید، و سپس روزانه با تغییرات محیط در هر ۳-۲ روز آنها را نگاه کنید تا زمانی که برای هاروست آماده می شوند.
اگر کشت ها رشد خیلی آهسته دارند و یا رشد ظاهری ندارند، ارزش آن را دارد که محیط را با محیط chang عوض کنید تا اینکه میزان رشد را بالا ببرید. اگر بعد از ۱۴-۱۰ روز هیچ رشد سلولی دیده نشد، به ناچار تکرار نمونه، مثل بالا در نظر گرفته می شود.
ساب کالچر با تریپسینه کردن
ساب کالچر در شرایط زیر لازم است.
۱- در صورتی که میزان رشد کم باشد، کلونی ها اجازه دارند که با هم تلاقی کنند و سپس ساب کالچر شوند، به این دلیل که تعداد کشت کافی داده شود و کشت اجازه هاروست داشته باشد.
۲- در کشت های چند تایی لازم است، در صورتیکه تست های اضافی مورد نیاز باشد تریپسینه کردن، یک قسمت کامل از روش هاروست سوسپانسیون است.
مواد و وسایل:
1-هود لامینار Class2
۲- انکوباتور37 درجه سانتی گراد (CO2 دار یا بدون CO2)
۳- سیلندر گاز
۴- لوله سانتریفوژ
۵- میکروسکوپ inverted
6- محیط کشت کامل که مناسب است
۷- پتری دیش پلاستیکی
۸- پیپت پاستور پلاستیکی
۹- TV) Trypsin – Versene)
روش کار:
۱- ابتدا محیط را بیرون بریزد و کشت (flowing or running together) confluent را با 0.5ml محلول (TV) استریل بشوئید.
۲- در این مرحله 1-2 ml محلول (TV) استریل اضافه کنید و در ۳۷ درجه سانتی گراد به مدت ۵ دقیقه انکوبه کنید.
۳- در زیر میکروسکوپ invert چک کنید، که سلول ها کاملا از سطح جدا شدن (detached) و کشت را برای اطمینان از یک سوسپانسیون سلولی بهم بزنید، یک میلی لیتر محیط کامل برای توقف عمل تریپسین اضافه کنید.
۴- سوسپانسیون را به داخل یک تیوپ ته مخروطی بریزید و به مدت ۵ دقیقه در دور 200g سانتریفوژ کنید.
۵- اگر نیاز است، به کشت اصلی، محیط تازه اضافه کنید و یا آن را دور بریزید.
۶- محلول رویی را بیرون بریزید (در شرایط استریل) و پلیت را به آرامی با نوک انگشتان بهم بزنید.
۷- مقدار مناسبی از محیط به هر کشت اضافه کنید. (کشتی که reseeded شده) مثلا 0.5ml در cover slip, در تیوپ 1ml یا در فلاسک 3 ml.
۸-ظروف کشت تازه را ressed کنید، میزان گاز مناسب، در ۳۷ درجه سانتی گراد انکوبه کنید (بهم نخورد) و حداقل ۶ ساعت یا overnight همانطوری که مناسب است انکوبه کنید.
نکته: معمولا Versene و تریپسین با هم مخلوط می شوند. ورسین (Versene) برای شستشوی سلول ها مورد استفاده قرار می گیرد و مقادیر اندک سرم و تریپسین را بر می دارد و سلول های سوبسترا را جدا می کند.
نکات ضروری حین انجام آزمایش
* تریپسین و Versene چشم ها و سیستم تنفسی و پوست را می سوزاند، و تریپسین می تواند برای دستگاه تنفسی حساسیت ایجاد کند.
* یون های منیزیم و کلسیم موجود در محیط کامل از فعالیت بیشتر تریپسین جلوگیری می کنند.
* اگر کشت ها در cover slip تریپسینه شوند، برای هاروست روز بعد آماده می شوند. سپس بعد از ۶ ساعت، 1.5ml محیط اضافه کرده و پروتکل کشت های cover slip هاروست درجا را دنبال کنید.

برای شرکت در دوره های تخصصی کارآموزی سیتوژنتیک و کاریوتایپ خون
از طریق لینک دوره های آموزشی تخصصی آزمایشگاه می توانید اقدام نمایید.
مرحله هاروست
در مرحله هاروست با اضافه کردن یک بازدارنده میتوتیک همانند کلسمید و رشد کشت با تحت تاثیر قرار دادن با محلول هایپوتونیک که سلول ها را متورم می کند، و در پایان سلول ها با استفاده از مخلوط با نسبت 3:1 متانول : اسید استیک فیکس می شوند.
هاروست درجا (in situ Harvesting)
این روش برای کشت هایی که مستقیما در cover slips یا اسلایدها رشد داده می شوند مورد استفاده قرار می گیرد. نکته ای که باید به آن توجه کنیم این است که، چون سلول ها روی سطحی که رشد داده می شوند، هاروست می شوند، مهم که لایه رشد سلولی خیلی ضخیم نباشد، چون این بر روی گسترش کروموزومی موثر است.
در آزمایشگاه های پیشرفته، پروسه با استفاده از یک هاروست کننده رباتیک انجام می شود (Hamilton Microlab 2200) که اجازه می دهد ۴۰ ظرف همزمان هاروست شوند. درست است که این اعمال طولانی تر از هاروست کشت با دست است، اما چندین مزیت دارد:
در وقت کارشناس صرفه جوئی می شود ( ۳ یا ۴ نفر کارشناس برای هاروست دستی ۴۰ کشت، مورد نیاز است).
دومین مزیت این است که روش قابل اعتماد و ثابتی است.
سومین مزیت این است که بخارات سمی فیکساتیو را در مکان محدود می کند.
هاروسترهای رباتیک تجاری: در هر دستگاه نرم افزاری نیاز است که مطابق با پارامترهای بهینه برای هاروست کردن از جمله جدا سازی محیط، جزء به جزء کردن (تقسیم) هایپوتونیک، اضافه کردن تدریجی و متوالی فیکساتیو به هایپوتونیک، جداسازی مخلوط هایپوتونیک فیکساتیو و تغییرات فیکساتیو است.
توضیحات تکمیلی
روش استاندارد، انتخاب کشت ها در صبح، پیش از هاروست واقعی و اضافه کردن مخلوط کلسمید و BrdU عصر همان روز است (تایمدین آنالوگ BrdU است که در رشته DNA تازه ساخت قرار گرفته و در این نواحی ایجاد decondensation خفیفی می کند که به ایجاد کروموزوم های بلندتر کمک می کند). این کشت ها، معمولا به صورت رباتیک هاروست می شوند.
مگر اینکه بیش از چهل نمونه برای هاروست وجود داشته باشد، و یا اگر مشکلی برای ماشین هاروستینگ اتفاق بیوفتد، که در این حالت لازم است که نمونه ها را دستی هاروست کنید. گاهی یک کشت اضافی لازم است، که یک مورد (بیمار) را کامل کند و در این موقعیت کلسمید به تنهائی به کار می رود.
دستورالعمل/پروتکل کشت های cover slip هاروست در جا
لوازم و محلول ها:
هود لامینار میکروبیولوژی Class2
انکوباتور CO2 دار در ۳۷ درجه سانتی گراد
پتری دیش پلاستیکی 35mm
پیپت پاستور پلاستیکی 1ml
پیپت پلاستیکی 5-10ml
فورسپس نازک
محلول مخلوط BrdU/ colcemid، ترکیب 3mg /ml (Sigma) BrdU محلول کار در PBS وکلسمید 1 µg/ml محلول کار در محیط کشت پایه MEM فیلترکنید و در درجه حرارت -20 درجه سانتی گراد نگهداری کنید.
میکروپیپت و tips (سرسمپلر) 50µl
هاروستر رباتیک (کاربردی)
محلول سدیم سیترات 0.8%
فیکساتیو: متانول – اسید استیک گلاسیال با نسبت 3:1
محیط کشت کامل
روش کار:
الف – هاروستینگ
۱- صبح، کشت های مناسب برای هاروست روز بعد را، انتخاب کنید.
۲- یا اینکه محیط را تغییر دهید، 2ml محیط تازه اضافه کنید و یا اگر رشد back-up در دیش اصلی وجود دارد cover slip را به یک دیش لیبل شده جدید منتقل کنید و 2 mlمحیط تازه اضافه کنید.
۳- در ۳۷ درجه سانتی گراد، تا حدود ساعت ۵ بعد از ظهر، در یک انکوباتور سه گازه یا CO2 دار، انکوبه کنید.
۴- تو این مرحله 50µl مخلوط Colcemid /BrdU به هر دیش اضافه کنید و در 37 درجه سانتی گراد در انکوباتور CO2 دار، overnight انکوبه کنید.
۵- صبح روز بعد، کشت ها را با استفاده از یک هاروستر روباتیک، با نرم افزاری که برای انجام مراحل شرح داده شده، طراحی شده، و یا مراحل ۱۳-۶ را به طور دستی دنبال کنید.
۶- مخلوط محیط /BrdU / کلسمید را بردارید، با 2 ml محلول سیترات سدیم ۸/.% جایگزین کنید، و سپس به مدت ۳۰ دقیقه در درجه حرارت اتاق بگذارید بماند.
۷- درست پیش از پایان ۳۰ دقیقه، فیکساتیو را درست کنید، و پتری دیش ها را بر روی درپوش قرار دهید.
۸- با استفاده از یک پیپت پاستور پلاستیکی، چهار قطره فیکساتیو به هر دیش اضافه کرده، و دو دقیقه منتظر بمانید (سعی کنید از قرار دادن فیکساتیو به طور مستقیم بر روی سلول ها اجتناب کنید.
۹- حالا ۸ قطره فیکساتیو اضافه کنید و ۲ دقیقه صبر کنید.
۱۰- بعد 2 ml فیکساتیو اضافه کنید و ۲ دقیقه منتظر بمانید.
۱۱- مخلوط هایپوتونیک / فیکساتیو را با استفاده از یک پیپت پاستور پلاستیکی جدا کنید و با 2 ml فیکساتیو تازه عوض کنید ( این مرحله یک بار با یک دیش برای جلوگیری از خشک شدن cover slips انجام دهید.)
۱۲- فیکساتیو تازه درست کنید و سه بار فیکساتیو را عوض کنید، بین هر تغییر یک دقیقه منتظر بمانید.
۱۳- فیکساتیو تازه برای تغییر فیکساتیو پایانی درست کنید، و سپس در پوش ها را تمیز کنید و آنها را روی دیش ها قرار دهید.
ب- تهیه گستره کروموزومی
۱- در این مرحله cover slip را از روی dish بردارید و فیکساتیو اضافی را بیرون بکشید ( با یک کاغذ جاذب برای اجتناب از طولانی شدن زمان خشک شدن و تجمع فیکساتیو).
۲- با کناره بالای سلول کار کنید، اجازه دهید cover slip تا مشاهده حلقه های نیوتن خشک شود. (اثر رنگین کمان غبار مانند که بر روی سطح ظاهر می شود)، یک قطره فیکساتیو از یک ارتفاع تقریبا 2cm بر روی لام بچکانید (این می تونه برای انجام spreading مناسب متفاوت باشد).
۳- اجازه دهید که قطره فیکساتیو به گوشه های cover slip برسد و بعد کاملا فیکس را بیرون بکشید و دوباره پیش از اینکه در معرض هوا خشک شود فیکس اضافه کنید. گاهی، لازم است که 2 قطره فیکساتیو برای تحریک اسپردینگ به کار ببرید.
۴- دراین مرحله cover slip را بر روی slid مونت کنید،طرف بالای سلول برای نواربندی آماده است.
توجه: BrdU می تواند صدمه ژنتیکی قابل توارث ایجاد کند، و به بچه متولد نشده (Unborn child) صدمه بزند، همچنین برای تنفس هم مضر است، و در تماس با پوست اگر بلعیده شود خطرناک است .
کلسمید هم سمی و خطرناک است، و اگر بلعیده شود، امکان خطر برای بچه متولد نشده دارد.
توجه: متانول خیلی قابل اشتعاله و برای دستگاه تنفسی سمی است. اسید استیک سوختگی های شدید ایجاد می کند و در تماس با پوست مضر است.
نکته: هاروستر رباتیک در آزمایشگاه برای اضافه کردن 3ml هایپوتونیک، و مراحل پرفیکس 0.375ml، 0.5ml و 2ml فیکساتیو طراحی شده. سپس مخلوط هایپوتونیک/فیکساتیو برداشته می شود و با 3ml فیکساتیو عوض می شود و بعد با چهار تعویض کامل فیکساتیو دنبال می شود.
بلافاصله به دنبال هاروست کروموزوم ها رو آماده کنید. اگر آماده نیست، دیش ها را در درجه حرارت اتاق قرار دهید و در فریزر نگهداری نکنید.
دستورالعمل/پروتکل هاروست در جا فقط با کلسمید:
مواد و وسایل:
هود لامینار Class2
انکوباتور سه گازه یا CO2 دار ۳۷ درجه سانتی گراد
پتری دیش های پلاستیکی 35ml
پیپت های پلاستیکی 5-10ml
پیپت پاستور پلاستیکی 1ml
فورسپس نازک
محلول کلسمید: 10µg/ml در HBSS
محلول سدیم سیترات، 0.8%
فیکساتیو: متانول _ اسید استیک گلاسیال، 3:1
محیط کشت کامل
روش کار:
۱- کشت های مناسب را برای هاروست انتخاب کنید.
۲- محیط راتغییر دهید یا cover slip را به یک دیش جدید منتقل کنید، و همانطور یکه مناسب است 2 ml محیط تازه اضافه کنید.
۳- دو قطره کلسمید از یک پیپت پاستور پلاستیکی1ml (50µl) را به هر دیش اضافه کنید.
۴- دیش ها را در ۳۷ درجه سانتی گراد در یک انکوباتور گاز دار به مدت ۷۵-۶۰ دقیقه انکوبه کنید.
۵- مخلوط محیط / کلسمید را بردارید و پروتکل ۳ را از مرحله ۶ دنبال کنید.
هاروست سوسپانسیون
این روش برای هاروست سلول های رشد داده شده در تیوب یا فلاسک استفاده می شود. سلول ها نمی توانند در جا هاروست شوند، بنابراین رشد بیشتر confluent، با جمع آوری سلول هایی است که به طور فعال در حال تقسیم در اطراف لبه های این تکه های ضخیم تر باشد. بسته به میزان رشد، کشت می تواند یا مستقیما هاروست شود و یا قبل از هاروست sub-culture انجام شود.
دستورالعمل/پروتکل هاروست سوسپانسیون
مواد و وسایل:
هود لامینار میکروبیولوژی class2
انکوباتور (گاز دار یا بدون گاز) در ۳۷ درجه سانتی گراد
پیپت پلاستیکی 5-10ml
پیپت پاستور پلاستیکی 1ml
پیپت پاستور شیشه ای 150mm
لوله های سانتریفوژ، ته مخروطی 10ml( ترجیحا شیشه ای)
میکروسکوپ اینورت (X4 چشمی)
اسلاید های تمیز شده میکروسکوپی
کلسمید / محیط Ham s F10 ( غلظت نهایی0.6 µg/ml کلسمید در Ham s F10 )
آب استریل
TV
فیکساتیو : متانول _ اسید استیک گلاسیال،3:1
روش کار:
۱- یک کشت مناسب برای هاروست انتخاب کنید، یا مستقیما و به دنبال تریپسینه کردن از روز قبل هاروست کنید.
۲- کشت را با colcemid / F10 Ham s 0.5ml شستشو دهید و 1 ml از این محیط اضافه کنید.
۳- در ۳۷ درجه سانتی گراد به مدت 24h انکوبه کنید.
۴- کشت را برای سلول های تقسیم شده جمع آوری شده چک کنید.
۵- محیط را بیرون بریزید، با TV 0.5ml استریل بشوئید و TV 1ml اضافه کنید. به مدت ۵ دقیقه در ۳۷ درجه سانتی گراد انکوبه کنید.
۶- از میکروسکوپ invert استفاده کنید. چک کنید که سلول ها از سطح جدا شدن و به تدریج لوله را تکان دهید تا مطمئن شوید یک سوسپانسیون تک سلولی ایجاد شده.
۷- در این مرحله 1.5ml آب استریل گرم اضافه کنید و در داخل یک لوله سانتریفوژ ته مخروطی بریزید (ترجیحا شیشه ای).
۸- به مدت ۵ دقیقه در دور 200g سانتریفوژ کنید.
۹- محلول رویی را بیرون بریزید ( در داخل ظرف استریل) و بتدریج لوله را تکان دهید تا دوباره پلیت به صورت سوسپانسیون در آید.
۱۰- به تدریج فیکساتیوی را که تازه ساخته شده قطره قطره با یک پیپت پاستور شیشه ای، در حالی که ته لوله را تکان می دهید تا مطمئن شوید پلیت سلولی کاملا مخلوط شده، اضافه کنید.
۱۱- در 20- درجه سانتی گراد به مدت ۳۰ دقیقه تا یک ساعت قبل از تهیه اسلاید نگهداری کنید.
۱۲- اسلایدها را همانطور که در تهیه لام در بخش کشت خون محیطی گفته شده درست کنید.
توجه: تریپسین چشم ها را می سوزاند، و به سیستم تنفسی و پوست آسیب وارد می کند و همچنین می تواند در اثر تنفس حساسیت ایجا کند.
دستورالعمل/روش پیپت
این روش هاروست، شامل آسپیره و جدا کردن سلول های در حال تقسیم از یک کشت در حال رشد است، پس از استفاده کردن کلسمید قبل از کشت آماده برای هاروست است. سپس سلول ها تحت اثر هایپوتونیک قرار می گیرند و قبل از چکاندن بر روی یک لام میکروسکوپی سریع فیکس می شوند. اگر چه این روش در مقیاس وسیع واقعا قابل کاربرد نیست ولی در یک آزمایشگاه تشخیصی شلوغ و فقط با یک سیستم کشت باز سازگار است.
آماده کردن کروموزوم
بدون در نظر گرفتن روش انتخابی هاروست، مشاهده نهایی برای متافازهای خوب پخش شده، قابل انجام است. بحرانی ترین مرحله خشک کردن preparation هاست. اگر preparations خیلی سریع خشک شوند، کروموزوم ها معمولا ضعیف اسپرد می شوند. و در زیر میکروسکوپ فاز کنتراست درخشان به نظر می رسند. بنابراین خشک کردن خیلی آهسته منجر به تولید کروموزوم های خیلی پخش می شود، یعنی کروموزوم هایی که ظاهر کمرنگ خاکستری دارند.
خشک شدن اسلایدهای کروموزومی به رطوبت بستگی دارد و به خوبی می دانید که spread کروموزومی تحت تاثیر شرایط آب و هوایی است. بهترین شرایط یک رطوبت نسبی تقریبا 50% و درجه حرارت حدود ۲۱ درجه سانتی گراد است. به طور ایده آل، یک اتاق با set یکنواخت air-condition برای کنترل درجه حرارت و رطوبت در یک سطح ثابت باید قابل دسترس باشد.
این شرایط آماده کردن، لام ها را استاندارد می کند و بنابراین نواربندی لام ها هم استاندارد می شود. قبل از G-banding این لام ها باید age شوند یا با نور UV ( germicidal 30w و طول موج 253.7nm ) برای تقریبا ۴۰ ثانیه یا استفاده از اجاق (۴۵ دقیقه در یک اجاق 60 درجه سانتی گراد یا overnight بر روی یک hot plate ).
پروتکل/دستورالعمل کاربردی کشت AF
۱-نمونه را به مدت ۱۰ دقیقه با دور 1000 rpm سانتریفوژ کنید.
۲- محلول رویی (supernatant) را حذف و محیط تازه به کشت اضافه کنید.
در اینجا با توجه به رسوبی که ایجاد شده، می توان تعداد لوله های کشت را انتخاب کرد و در صورت کشت در لوله 1-5 cc Lighton محیط و کشت در فلاسک 3 cc محیط اضافه کنید.
۳- بعد از ۷-۵ روز نمونه را به آرامی از انکوباتور خارج و با میکروسکوپ اینورت آن را بررسی کنید. در صورت مشاهده کلنی، محیط آن را برداشته و با محیط تازه تعویض کنید.
۴- دو روز درمیان، نمونه ها را با میکروسکوپ اینورت بررسی کرده و محیط آن را تعویض کنید.
۵- بعد از رشد کلونی به اندازه کافی، می شود یکی از لوله ها را هاروست کرده و لوله دیگه را subculture داد.
۶- subculture کردن نمونه، به این صورت است، که نمونه مورد نظر را انتخاب کرده، سپس محیط آن را در لوله ای جداگانه می ریزیم، سپس نمونه را با PBS 37 درجه شستشو داده و محلول اون رو به لوله فوق اضافه می کنیم. ( دو بار با PBS می شوئیم).
۷,۱- به لوله 0.5cc Lighton، و به فلاسک 1cc محلول (1X) ،trypsin-EDTA، 37 درجه سانتی گراد بریزید و به مدت ۳۰ ثانیه درون ۳۷ درجه قرار دهید. ( برای جدا شدن ضربه بزنید، زیر میکروسکوپ اینورت نگاه کنید ۲ بار با PBS 0.5cc شستشو، و بعد تریپسین EDTA ۳۷ درجه، بعد ضربه، به محیط کشت اضافه کنید).
۷,۲- با جدا شدن سلول ها از سطح ظرف کشت، برای خنثی کردن اثر trypsin به آن 1 cc محیط کامل حاوی سرم اضافه کنید.
۷,۳- سپس با توجه به مقدار نمونه، درون ظرف های دیگه اونرو aliquot کنید. و با توجه به نوع ظرف به آن محیط تازه اضافه کنید و در انکوباتور ۳۷ درجه قرار دهید ( قسمت ۷,۳ فقط برای subculture دادن نمونه هاست).
۸- برای هاروست به ازای هر 1cc حدودا ۷۵ میکرولیتر کلسمید اضافه کنید و ۴-۳ تا ساعت در ۳۷ درجه انکوبه کتید. پس از این مدت طبق قسمت شماره ۷ سلول ها را trypsinized کرده و سوسپانسیون سلولی را در لوله جداگانه نگهداری کنید.
۹- پس از جدا شدن و جمع آوری سوسپانسیون آن را به مدت ۱۵ دقیقه با دور 1000 rpm سانتریفوژ کنید.
۱۰- تو این مرحله supernatant را برداشته و به آن محلول هایپوتونیک 0.75 M KCI اضافه کنید و به مدت ۱۰ دقیقه در ۳۷ درجه انکوبه کنید.
۱۱- سپس سانتریفوژ کرده و پس از حذف supernatant به اون Fix 3:1 5cc ( متانول ۳: اسید استیک ۱) اضافه کرده و آن را ۲۰ دقیقه به همین حالت قرار دهید (همان موقع هاروست کنید).
۱۲- پس از ۲۰ دقیقه، نمونه را سانتریفوژ کنید و مجددا فیکس اضافه کنید و ۲۰ دقیقه دیگه در همین حالت آن را قرار دهید. ( یا همون موقع هاروست کنید).
۱۳- سپس نمونه را سانتریفوژ و غلظت سوسپانسیون را برای لام گیری آماده کرده و از نمونه لام گیری کنید.
نکته: مراحل ۸-۱ در شرایط استریل انجام بشه.
پروتکل ها بر اساس set up آزمایشگاه ها متفاوت هستند.