چگونه می توان ژن یک بیمار ژنتیکی را شناسایی کرد؟
نحوه شناسایی بیماران ژنتیکی و ژن درمانی:
در ژن درمانی برای شناسایی ژن ایجاد کننده بیماری فقط یک راهکار وجود ندارد، بهترین روش بستگی به این دارد چه اطلاعاتی در دسترس ما است. برای اینکه اصول کار را دریابیم سخت ترین حالت ممکن که اغلب شایع ترین حالت نیز هست را در نظر می گیریم. یعنی زمانی که تنها اطلاعاتی که از بیمار در دست ماست چند بیمار مبتلا به آن است. حتی با چنین نقطه ی شروع مایوس کننده ای تکنیک های DNA می توانند جایگاه ژن مربوطه را شناسایی کنند.
ژن درمانی؛ شناسایی تقریبی ژن در ژنوم انسان
اگر هیچ اطلاعاتی در مورد ژن مورد نظر نداشته باشیم چگونه می توان آن را در ژنوم انسان شناسایی کرد؟
پاسخ آن است که باید با استفاده از ژنتیک پایه، جایگاه تقریبی ژن را روی نقشه ژنتیکی پیدا کنیم. نقشه ژنتیکی معمولا به روش آنالیز پیوستگی (linkage analysis) تهیه می شود. که در آن الگوی وراثتی ژن مورد نظر با الگوی وراثتی جایگاه ژنتیکی شناخته شده مقایسه می شود.
اگر دو جایگاه باهم به ارث برسند باید روی یک کروموزوم و بسیار نزدیک به هم باشند. اگر نزدیک به نباشند آنگاه وقایع نوترکیبی و تفکیک تصادفی کرموزوم ها حین میوز باعث شده است که جایگاه مورد نظر الگوی وراثتی شمتفاوتی را نشان دهد. اگر آن دو روی یک کروموزوم اما دور از هم هستند، وقایع نوترکیبی گه گاها آن ها را از هم جدا می کند. تعیین پیوستگی با یک یا چند جایگاه ژنتیکی نقشه برداری شده، کلید کشف جایگاه کروموزومی ژن مورد نظر است.
در مورد انسان امکان انجام برنامه های تولیدمثلی مستقیم که هدف آن تشخیص جایگاه یک ژن خاص باشد وجود ندارد. به جای آن، تعیین جایگاه ژن بیماری در انسان باید با استفاده از بررسی داده های شجرنامه هایی انجام شود که شروع این بیماری خاص در آن شجره بالاست.
به این نکته باید توجه داشت که باید بتوانیم نمونه های DNA را حداقل از سه نسل از فامیل بگیریم و هرچه تعداد اعضای فامیل بیشتر باشد بهتر است. به جز در مواردی که بیماری شیوع بسیار کمی دارد، معمولا امکان پیدا کردن یک شجرنامه مناسب مشکل نخواهد بود.
پیوستگی از طریق مطالعه ی حضور یا عدم حضور بیماری و وراثت مارکرهای DNA انجام می شود. یک مارکر DNA، توالی از DNA است که متغییر می باشد و به دو یا چند فرم آللیک وجود دارد و مکان آن در ژنوم مشخص است. برای نشان داددن نحوه استفاده از آنالیز پیوستگی با مارکرهای DNA، به بیان روشی می پردازیم که در آن یکی از ژن های مسئول بروز سرطان سینه نقشه برداری شد.
ژن درمانی؛شناسایی ژن هایی که ممکن است ژن مسئول بیماری باشند
ممکن است این طور تصور کنید که وقتی جایگاه ژن بیماری شناسایی شد، قدم بعدی این است که به سادگی با مراجعه به توالی ژنوم، ژن مورد نظر را شناسایی کنیم. متاسفانه هنوز کارهای زیادی باید انجام شود. نقشه برداری ژنتیکی حتی در این حالت بسیار دقیق، فقط جایگاه تقریبی ژن را مشخص می کند. در پروژه ی سرطان سینه، محققان بسیار خوش اقبال بودند که توانستند محدوده ی ژن را به ۶۰۰ کیلو باز کاهش دهند.
در اغلب موارد توالی حدود ۱۰ میلیون باز یا حتی بیشتر مورد بررسی قرار گیرد. چنین طول بزرگی از DNA حاوی ژن های زیادی می باشند. یعنی ناحیه ی ۶۰۰ کیلو بازی دربردارنده ی ژن سرطان سینه حاوی بیش از ۶۰ ژن است که هر کدام از آن ها می توانند ژن سرطان سینه باشند.
روش های مختلف برای شناسایی اینکه کدام ژن از ناحیه نقشه برداری شده مسئول بیماری می باشد
۱- الگوی بیان ژن مورد نظر، می تواند به کمک بررسی های هیبریداسیون و یا روش RT-PCR روی RNA بافت های مختلف، مورد مطالعه قرار گیرد. به طور مثال انتظار می رود که ژن BRCA1 با RNA تهیه شده از بافت سینه و همچنین بافت تخمدان هیبرید شود. سرطان تخمدان اغلب با سرطان سینه توارثی مرتبط است.
۲- هومولوگ های ژن مورد نظر در سایر گونه های پستانداران را می توان با جستجوی توالی آن ها به کمک BLAST مورد بررسی قرار داد. این آزمون بر این اساس است که یک ژن مهم انسانی که جهش در آن باعث بیماری می شود، تقریبا همیشه همولوگ هایی در دیگر پستانداران نیز خواهد داشت. آنالیز یکسانی را می توان از طریق هیبریداسیون ساترن با DNA گونه های مرتبط انجام دهیم که به این روش Zoo blot می گویند. اگر یک ژن همولوگ وجود داشته باشد، به کمک هیبریداسیون با پروب های مناسب قابل شناسایی خواهد بود حتی اگر ژن همولوگ تقریبا توالی متفاوتی از ژن مورد نظر انسانی داشته باشد.
۳- با مطالعه توالی ژنی افراد بیمار و غیر بیمار می توان به دنبال موتاسیونی در ژن های فرد مبتلا گشت که بیانگر علت بیماری باشد.
۳- برای تایید بیشتر می توان یک موش ناک اوت ایجاد کرد که دارای فرم غیر فعال ژن مورد نظر است. اگر موش ناک اوت علائمی را بروز دهد که مشابه فرد بیمار است، می توان اطمینان حاصل کرد که ژن کاندید، همان ژن مسئول بیماری است.
با انجام این آزمون ها روی ناحیه ی بین D17S1321 و D17S1325، بالاخره یک ناحیه ی تقریبا ۱۰۰ کیلو بازی شناسایی شد که از ۲۲ اگزون کد کننده برای پروتئینی با ۱۸۶۳ اسیدآمینه تشکیل شده است. این ناحیه کاندید اصلی ژن BRCA1 بود. رونوشت های ژن در بافت سینه و تخمدان شناسایی شد و همچنین هومولوگ هایی از آن در موش، رت، خرگوش، خوک و گوسفند پیدا شد اما همولوگ آن در مرغ دیده نشد.
نکته ی مهمتر اینکه ژن این پنج خانواده ی حساس به سرطان سینه دارای موتاسیون هایی از نوع frameshift و nonsense بودند که منجر به ایجاد یک پروتئین بدون عملکرد می شد. با این شرایط شواهد به اندازه ی کافی قانع کننده بود که بگوییم ژن مورد نظر همان BRCA1 است. تحقیقات بعدی نشان داد که این ژن و ژن BRCA2 که آن هم در ابتلا به سرطان سینه نقش دارد، در تنظیم رونویسی و ترمیم DNA دخالت دارند و هر دو به عنوان یک سرکوب کننده ی تومور عمل می کنند که از تقسیم سلول های غیر نرمال جلوگیری می کنند.
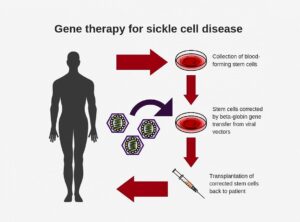
ژن درمانی
هدف ژن درمانی، استفاده از روش هایی است که به کمک آن ها نسخه ی صحیحی از ژن مورد نظر به بیمار دارای ژن معیوب منتقل شود و منجر به درمان بیماری ارثی شود. امروزه مسیر ژن درمانی به این سو پیش می رود که برای درمان هر نوع بیماری یک ژن را کلون کرده و وارد بیمار کنند.
ژن درمانی برای بیماری های ارثی
دو روش اصلی برای ژن درمانی وجود دارد. ژن درمانی سلول های زایا و ژن درمانی سلول های سوماتیک.
در ژن درمانی سلول های زایا، درون تخم بارور شده فرم صحیح ژن مورد نظر را وارد کرده و این سلول را دوباره در رحم مادر قرار می دهیم. اگر روش با موفقیت انجام شود ژن مورد نظر در تمام سلول های حاصل از آن وارد شده و بیان می شود. ژن درمانی سلول های زایا معمولا با تزریق به درون سلول سوماتیک و سپس انتقال هسته ی آن به یک تخمک انجام می دشود و به صورت نظری برای درمان کلیه بیماری های ارثی قابل انجام است.
در ژن درمانی سلول های سوماتیک سلول مورد نظر از ارگانیسم جدا شده و ترانسفکشن می شود و سپس به بدن موجود زنده بازگردانده می شود و یا در یک روش دیگر ترانسفکشن بدون جداسازی سلول از ارگانیسم انجام می شود. این تکنیک بیشتر برای بیماری های خونی ارثی (مانند هموفیلی و تالاسمی) نوید بخش خواهد بود، زیرا می توان ژن صحیح را به سلول های بنیادی مغز استخوان انتقال دهیم و سپس آن ها را به تمام انواع سلول های تخصص یافته ی خونی انتقال داده می شوند.
در این روش ابتدا عصاره ی مغز استخوان را که حاوی چندین میلیارد سلول است را تهیه کرده، سپس آن ها را با وکتور های رتروویروسی ترانسفکت می کنیم و پس از آن سلول ها به بدن بازگردانده می شود. متعاقبا تکثیر و تمایز سلول های ترانسفکت شده منجر به اضافه شدن این ژن در تمام سلول های بالغ خونی می شود. مزیت وکتور های رتروویروسی این است که توانایی ترانسفکشن بسیار بالایی دارند به طوری که وارد بخش اعظمی از سلول های بنیادی موجود در عصاره ی مغز استخوان خواهند شد.
ژن درمانی سلول های سوماتیک همچنین توانایی بالقوه ای در درمان بیماری های ریوی مانند سیستیک فیبروزیس دارد. در این مورد DNA کلون شده وارد یک وکتور آدنوویروسی یا لیپوزوم شده و پس از وارد شدن به مجرا تنفسی از طریق افشانه، توسط سلول های اپی تلیال ریه برداشت می شود، گرچه بیان ژن فقط برای چند هفته تداوم می یابد و این روش به عنوان یک روش درمانی موثر برای سیستیک فیبروزیس، محسوب نمی شود.
در مورد بیماری های ژنتیکی که در اثر موتاسیون، ژن مورد نظر پروتئینی فاقد عملکرد را کد می کند تنها کاری که باید انجام دهیم رساندن سلولی با فرم صحیح ژن مورد نظر به بدن است و دیگر نیازی به حذف ژن معیوب نمی باشد. اما این راهکار برای بیماری های ژنتیکی غالب مناسب نمی باشد، زیرا محصول ژن معیوب به خودی خود عامل ایجاد بیماری است و بنابراین برای درمان این بیماری ها نه تنها وارد کردن ژن صحیح ضروری است بلکه ژن معیوب هم باید حذف شود.
این کار نیازمند سیستم تحویل ژنی است که در آن نوترکیبی بین ژن کروموزومی و ژن موجود در وکتور انجام شود و این دو ژن معیوب و سالم با هم تعویض شوند. این تکنیک پیچیده و نامطمئن است و هنوز روش های کاربردی گسترده ای برای آن ایجاد نشده است.