وسترن بلات، تکنیکی برای تشخیص وجود، بررسی میزان بیان و تغییرات پس از ترجمه پروتئین ها
وسترن بلات، که گاهی اوقات ایمونوبلات پروتئینی نیز نامیده می شود، یک تکنیک مبتنی بر آنتی بادی است که برای تشخیص وجود، اندازه و فراوانی پروتئین های خاص در یک نمونه مخلوط از پروتئین های مختلف استخراج شده از سلول یا بافت استفاده می شود. این تکنیک در سال 1979 توسط هری تاوبین و همکارانش توسعه یافت و بعداً به دلیل شباهت این تکنیک به ساترن بلات، وسترن بلات نام گرفت. وسترن بلات، نخستین بار از مرکز تحقیقاتFriedrich Miescher Institute for Biomedical Research (FMI) بازل سوئیس معرفی شد.
انواع روشهای بلاتینگ
ساترن بلات
ساترن بلات روشی بر اساس هیبریداسیون است که در سال 1975 ادوین ساترن ابداع شد. در این روش همانند وسترن بلات، نمونه ها با الکتروفورز جدا شده(در صورتی که ژل قابلیت دناتوراسیون را نداشته باشد از محلول هیدرو کسید سدیم استفاده می شود) و بر روی غشای نیتروسلولزی منتقل می شوند(مرحله ترنسفر). ساترن بلات برای تشخیص توالی های DNA خاص استفاده می شود در حالی که وسترن بلات برای تشخیص پروتئین های خاص در مجموعه ای از پروتئین ها طراحی شده است.
از تکنیک ساترن بلات برای تشخیص هویت در پزشکی قانونی، شناسایی جایگاه یک ژن در ژنوم، تشخیص واریانت ها، جستجوی RFLPs و… استفاده می شود. ساترن بلات، روش موثر و انتخابی برای تشخیص بیماریهای تکرار سهتایی (Trinucleotide repeat diseases) می باشد.
نورترن بلات
نورترن بلاتینگ که در سال 1977 توسط جیمز آلواین، دیوید کمپ و جورج استارک در دانشگاه استنفورد توسعه یافت، برای شناسایی توالیهای mRNA خاص استفاده میشود. همانند وسترن و ساترن بلات، نمونه های تحت نور در بلات با الکتروفورز جدا شده و به غشاء منتقل می شوند و قطعات cDNA با توالی هایی که مکمل ناحیه مورد نظر هستند، قبل از تشخیص به عنوان پروب استفاده می شوند.
نورترن بلات برای مطالعه و آنالیز بیان ژن، اندازه گیری سایز mRNA و مطالعات بر روی RNA ها از جمله RNA splicing ، RNA Biological half-life ،شناسایی انواع جدید microRNAs چک کردن موش های ناک اوت شده و ترانس ژنیک کاربرد دارد.
نورترن بلات میتواند تغییرات کوچک در بیان ژن را در لحظه شناسایی کند در حالی که میکرواری این قابلیت را ندارد اما مزیتی که میکرواری نسبت به نورترن بلات دارد این است که در میکرواری میتوان چندین هزار ژن را به صورت یکجا و همزمان مورد بررسی قرار داد در حالی که در نورترن بلات تعداد کمی از ژنها را می توان بررسی کرد.
نورترن بلات نسبت به تکنیک RT-PCR دارای حساسیت کمتری است اما اختصاصیت بالا دارد که مانع از نتایج مثبت کاذب می شود (false positive results). همچنین نتایج بیش از 1000 نسخه نوترن بلات از نمونه های انسانی و موشی برای انواع مختلف یافت ها و ژن ها در پایگاه داده BlotBase را منتشر شده است.
وسترن بلات
به انتقال مولکول های تفکیک شده در الکتروفورز از ژل به یک غشاء اختصاصی، بلات کردن یا لکه گذاری وسترن بلات گفته میشود. نفوذپذیری پایین و خروج پروب ها از ژل باعث ایجاد مشکل در فرآیند آشکارسازی می شود. از این جهت برای انجام هیبریداسیون اسیدهای نوکلئیک و شناسایی پروتئین ها استفاده از غشا مناسب می باشد.
به طور خلاصه، وسترن بلات اغلب در تحقیقات برای جداسازی و شناسایی پروتئین ها استفاده می شود. در این روش مخلوطی از پروتئین ها بر اساس وزن مولکولی و نوع آنها، از طریق ژل الکتروفورز جدا می شود. پس از انتقال به غشای نیتروسلولزی، نمونه ها با استفاده از آنتی بادی های خاص انکوبه می شوند. این آنتی بادی ها را می توان شناسایی کرد و اندازه و فراوانی پروتئین های متصل را در مقایسه با استانداردها یا کنترل های شناخته شده ارزیابی کرد.
تفاوت وسترن بلات با SDS-PAGE
SDS-PAGE یک تکنیک الکتروفورز است که برای جداسازی پروتئین ها بر اساس جرم مولکولی آنها استفاده می شود، در حالی که وسترن بلات کل فرآیند مورد نیاز برای تشخیص وجود یک پروتئین خاص است. SDS-PAGE اغلب روش الکتروفورز است که در پروتکل وسترن بلات به عنوان وسیله ای برای جداسازی تمام پروتئین های داخل نمونه قبل از بلاتینگ انتخاب می شود.
مراحل وسترن بلات
- جداسازی مولکول ها بر اساس اندازه
- انتقال به غشاء جامد
- نشانه گذاری(لکه گذاری) پروتئین هدف با استفاده از یک آنتی بادی اولیه و ثانویه مناسب
دلایل زیادی وجود دارد که ممکن است برای تعیین وجود یا عدم وجود و اندازه یک پروتئین خاص در یک نمونه نیاز داشته باشید. برای تشخیص یا بررسی بیماری، تعیین موفقیت یا شکست آزمایشهای دستکاری ژنتیکی یا شناسایی وجود پروتئینهای بالقوه آلرژیزا در یک نمونه غذا. برای تعیین دقیق پروتئین مورد نظر خود، اغلب باید آن را از پس زمینه بسیاری از مولکول های دیگر که ممکن است برخی از آنها خواص یا اندازه مشابهی داشته باشند، متمایز کنید. وسترن بلات تکنیی است این قابلیت ها را ارائه می دهد.
جداسازی مولکول ها
اولین مرحله در وسترن بلات، آماده سازی نمونه پروتئین و مخلوط کردن آن با ماده شوینده ای به نام سدیم دودسیل سولفات است که باعث می شود پروتئین ها به صورت زنجیره های خطی باز شوند و سپس با بار منفی پوشش داده شوند. سپس مولکول های پروتئین با توجه به اندازه آنها با روش الکتروفورز ژل پلی آکریل آمید(SDS-PAGE) جدا می شوند.
اگر پروتئین مورد نظر شما در بخش نامحلول (مثلاً پروتئین های متصل به غشای سلولی) است، ابتدا روش های پیش تصفیه را برای آزادسازی و حل شدن آن بررسی کنید. مواد جامد عملکرد ژل را مختل می کنند و به احتمال زیاد پروتئین مورد نظر شما در ژل انباشته باقی می ماند.
انتقال پروتئین (ترنسفکشن)
در مرحله دوم آزمایش وسترن بلات پروتئین ها باید از ژل پروتئینی به غشای مناسب (معمولا نیتروسلولز یا پلی وینیلیدین دی فلوراید / PVDF) برای تسهیل بررسی آنتی بادی منتقل شوند. تعدادی از تکنیک ها را می توان برای انتقال استفاده کرد، از جمله انتقال مویرگی، انتقال بواسطه انتشار و وکیوم بلات، اما رایج ترین آنها به دلیل سرعت و کارایی آن، الکتروبلات(انتقال الکتروفورتیک) است. در این مرحله، ژل پروتئین در برابر غشای انتقال، ساندویچ می شود و جریان الکتریکی اعمال می شود. پروتئین های حاصل از ژل در سراسر آن حمل شده و محکم به غشاء متصل می شوند.
در الکتروبلات، استراتژی های متعددی برای انتقال وجود دارد که به عنوان انتقال مرطوب، نیمه خشک و خشک شناخته می شوند. انتقال مرطوب کارآمد است و بافر انعطاف پذیری را ارائه می دهد اما زمان بر است. انتقال نیمه خشک سریعتر است و همچنان انعطاف پذیری را ارائه می دهد، اما نسبت به انتقال مرطوب برای پروتئین های بزرگ کارآمدتر است. انتقال خشک کارآمد و سریع است اما انعطاف پذیری کمتری نسبت به روش های دیگر ارائه می دهد. راندمان انتقال را می توان قبل از کاوش با استفاده از یک نمک مانند Ponceau S ارزیابی کرد.
پس از جداسازی، پروتئین ها از ژل به یک غشای بلات منتقل می شوند. هنگامی که انتقال کامل شد، غشاء تمام نوارهای پروتئینی را در اصل روی ژل حمل می کند.
مسدود کردن
با توجه به میل ترکیبی بالای غشاهای بلاتینگ برای پروتئین ها، پس از انتقال، مهم است که مکان های اتصال باقی مانده را مسدود کنید تا از اتصال غیر اختصاصی بعدی آنتی بادی های تشخیص سنجش جلوگیری شود. این امر با انکوباسیون غشاء با یک مایع پروتئینی مانند سرم حاصل می شود.
غشاء از طریق روشی به نام مسدود کردن عبور می کند که از بروز هرگونه واکنش غیر اختصاصی جلوگیری می کند. سپس غشاء با آنتی بادی به نام آنتی بادی اولیه انکوبه می شود که به طور خاص به پروتئین مورد نظر متصل می شود.
شستشوی غشا
پس از انسداد، شستن غشا بین هر مرحله برای حذف معرف های اضافی یا غیر متصل مهم است. شستشوی ناکافی یا ناهموار می تواند منجر به لکه گذاری های بی کیفیت و پس زمینه بالا شود. با این حال، شستشوی بیش از حد می تواند سیگنال هدف را کاهش دهد، بنابراین مهم است که تعداد و مدت مراحل شستشو را بهینه کنید.
اطمینان حاصل کنید که غشا به خوبی با یک بافر مناسب پوشانده شده است و به آرامی مخلوط کنید. بافرهای رایج مورد استفاده عبارتند از: تریس بافر سالین (TBS) و سالین بافر فسفات (PBS)، که اغلب شامل Tween 20 (TBST و PBST).
استریپینگ (stripping) فرآیند حذف آنتی بادی های اولیه و ثانویه از غشای وسترن بلات است. اگر بخواهید بیش از یک پروتئین هدف را در یک لکه گذاری(نشانه گذاری) خاص به جای اجرای چندین بلات بررسی کنید، برای مثال در مواردی که نمونه ها بسیار ارزشمند یا کمیاب هستند، می تواند مفید باشد. توجه داشته باشید که استریپینگ ممکن است مقداری پروتئین را نیز از غشاء حذف کند، بنابراین مقایسه کمی قبل و بعد از جداسازی امکان پذیر نیست و بررسی عدم وجود پروتئین روی غشای جدا شده نباید انجام شود.
اگر میخواهید نشانه گذاری خود را از بین ببرید، استفاده از غشاهای PVDF توصیه میشوند زیرا در حفظ پروتئینها پس از جداسازی بهتر از نیتروسلولز هستند. در مقابل از لحاظ هزینه نیتروسلولز ارزان تر می باشد.
انکوباسیون و لگه گذاری
در حالی که می توان از تشخیص مستقیم (یک آنتی بادی منفرد که هدف را تشخیص می دهد و قابل تشخیص است) برای وسترن بلات استفاده کرد، اغلب از روش غیر مستقیم استفاده می شود. در اینجا، یک آنتی بادی اولیه برای بررسی غشاء و اتصال به پروتئین هدف استفاده می شود. سپس از یک آنتی بادی ثانویه استفاده می شود که به آنتی بادی اولیه متصل می شود و قابل تشخیص است. مانند تمام مراحل، بهینه سازی، انتخاب آنتی بادی و تعیین غلظت بهینه، کلید یک نشانه گذاری خوب است.
پس از انکوباسیون، هر آنتی بادی اولیه غیر متصل شسته می شود و غشاء دوباره انکوبه می شود، اما این بار با یک آنتی بادی ثانویه که به طور خاص آنتی بادی اولیه را می شناسد و به آن متصل می شود. آنتی بادی ثانویه به یک آنزیم گزارشگر مرتبط است که رنگ یا نور تولید می کند که به راحتی قابل تشخیص و تصویربرداری است. این مراحل اجازه می دهد تا یک پروتئین خاص از میان مخلوطی از پروتئین ها شناسایی شود.
آنتی بادی غیر متصل شسته می شود و تنها آنتی بادی متصل به پروتئین مورد نظر باقی می ماند. سپس آنتی بادی های متصل شده با ایجاد فیلم شناسایی می شوند. از آنجایی که آنتی بادی ها فقط به پروتئین مورد نظر متصل می شوند، تنها یک نوار باید قابل مشاهده باشد. ضخامت نوار مربوط به مقدار پروتئین موجود است. بنابراین انجام استفاده از یک نشانگر(Ladder) استاندارد می تواند میزان پروتئین موجود را نشان دهد.
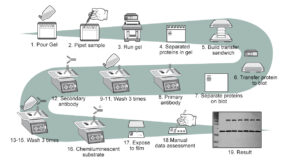
مراحل وسترن بلات
روش های آشکارسازی
روشهای متعددی برای تشخیص وسترن بلاتها از جمله کروموژن (رنگسنجی)، فلورسنت، کمی لومینانس و رادیواکتیو وجود دارد.
هر دو روش آشکارسازی کروموژن و کمی لومینانس نیاز به کونژوگاسیون یک آنزیم به آنتی بادی تشخیص دارند و تکنیک های بسیار حساسی در نظر گرفته می شوند. پراکسیداز ترب کوهی(HRP) و آلکالین فسفاتاز(AP) متداول ترین آنزیم های مورد استفاده هستند که HRP به دلیل پایداری، سازگاری با اکثر کونژوگاسیون ها و هزینه کم، عموما مورد علاقه است. در حین تشخیص، یک سوبسترا به غشاء اضافه می شود که توسط آنزیم کونژوگه بر روی آن اثر می گذارد و یک تغییر شیمیایی ایجاد می کند.
در صورت انجام رنگ سنجی، یک بستر کروموژنیک انتخاب می شود که تغییری ایجاد می کند که می تواند مستقیماً قابل مشاهده باشد. با این حال، تصویربرداری سریع از نشانه گذاری مهم است زیرا رنگ ها با خشک شدن نشانه محو می شوند. در تشخیص کمی لومینانس، سیگنال تولید شده تنها تا زمانی که واکنش بین آنزیم و سوبسترا در حال وقوع است (معمولاً 1-24 ساعت) دوام می آورد. در طول این مدت، سیگنال را می توان با نوردهی فیلم اشعه ایکس یا استفاده از تصویربرداری دیجیتال برای ایجاد یک رکورد دائمی ضبط کرد.
در آشکارسازی فلورسنت، آنتی بادی تشخیص به جای آنزیم با یک فلوروفور کونژوگه می شود. هنگامی که نوری با طول موج مشخص به آنها تابیده می شود، برنگیخته می شوند و نوری با طول موج خاص ساطع می کنند. سپس میتوان این تصویر را ثبت کرد. در حالی که تجهیزات تخصصی برای انجام مراحل تحریک و تشخیص مورد نیاز است، هیچ مرحله دیگری در تشخیص فلورسنت وجود ندارد و پروتکل را کوتاه می کند. همچنین امکان مالتیپلکس کردن فلوروفورها در روش وسترن بلات وجود دارد.
در آشکارسازی رادیواکتیو، که در آن یک رادیو ایزوتوپ به آنتی بادی تشخیص کونژوگه می شود و تشعشعات ساطع می شود.
کنترل لودینگ برای وسترن بلات
هنگام مقایسه بیان پروتئین بین نمونه های مختلف، دانستن اینکه چه مقدار نمونه بارگذاری شده است ضروری است، زیرا ممکن است این موضوع به تنهایی از طریق بلات مشخص نباشد. به عنوان مثال، هنگام ارزیابی یک لکه، نوار یک نمونه ممکن است دو برابر روشن تر از نمونه دیگر به نظر برسد. این می تواند به این معنی باشد که دو برابر بیشتر از پروتئین هدف در آن نمونه وجود دارد، یا می تواند به این معنی باشد که نمونه بیشتری یا نمونه غلیظ تری در یک خط نسبت به دیگری بارگذاری شده است.
اجرای یک ژل پروتئینی تکراری با Coomassie Stain میتواند به رفع این عدم قطعیت کمک کند، زیرا مقدار کل پروتئین را در هر خط نمونه نشان میدهد و میتواند هرگونه ناسازگاری بارگذاری را آشکار کند. تشخیص بیان یک پروتئین در همه جا که باید بین تمام نمونههای شما یکنواخت باشد، مانند اکتین در نمونههای سلول کامل و سیتوپلاسمی، میتواند به عنوان کنترل بارگذاری نیز استفاده شود و به اطمینان از انتقال مداوم نمونههای پروتئین به غشاء کمک میکند. با این حال، این نوع کنترل می تواند در مقایسه مدل هایی که در آن پروتئین های کنترل به طور متفاوت بیان می شوند، مشکل ساز باشد.

برای یادگیری و آموزش تکنیک وسترن بلات
از طریق لینک دوره های آموزشی تخصصی آزمایشگاه می توانید اقدام نمایید.
تفسیر نتایج
هنگام استفاده از فیلم اشعه ایکس برای به دست آوردن نتایج از آزمایش وسترن بلات، اغلب لازم است چندین فیلم را برای بهینه سازی نوردهی در معرض دید قرار دهید. اگر باندهای نمونه به اندازه کافی طولانی نیست، ممکن است کم رنگ باشند یا اصلا قابل مشاهده نباشند. و اگر خیلی طولانی است و سیگنال پسزمینه خیلی قوی میشود، باندها با هم ادغام میشوند و لکه حاصل بسیار تاریک است و تفسیر آن سخت است.
اگر کنترلها یا نشانگرهای اندازه از نظر غلظت با هدف متعادل نباشند نیز میتوانند مشکل ساز باشند، زیرا یکی قبل از اینکه دیگری به اندازه کافی قابل مشاهده باشد، بیش از حد در معرض دید قرار میگیرد. سپس ممکن است فیلم ها برای بازبینی بیشتر با استفاده از نرم افزار تحلیل، دیجیتالی شوند.
روشهای تشخیص با استفاده از فیلم اشعه ایکس، کیفی یا نیمه کمی در نظر گرفته میشوند. اگر کمیت مورد نیاز باشد، مقایسه باندها در خطوط نمونه با کنترل ها و نشانگرهای اندازه می تواند به تعیین وجود یا عدم وجود یک هدف در یک نمونه کمک کنند. برای مثال، تصویربرداری دیجیتال با دستگاه های مبتنی بر دوربین CCD، به دلیل دامنه دینامیکی بزرگتر، حساسیت بیشتر و وضوح بالاتر، گزینه بهتری هستند. همچنین می توان نسبت سیگنال به نویز را بهینه کرد. سپس به راحتی به نرم افزاری وارد شود که می تواند داده ها را تجزیه و تحلیل و مقایسه کند.

برای دریافت خدمات وسترن بلات و انجام سایر تست های ژنتیک مولکولی
از طریق لینک خدمات آزمایشگاهی می توانید اقدام نمایید
ترابل شوتینگ
موارد زیادی در پروتکل وسترن بلات وجود دارد تا همه چیز اشتباه شود، در اینجا چند مشکل رایج را بررسی میکنیم و راهحلهای بالقوه را برای رفع اشکالات یا عیب یابی وسترن بلات ارائه می دهیم.
- در صورت جداسازی ناکافی یا موقعیت ضعیف نوارهای پروتئینی روی ژل، درصد ژل پروتئین و زمان اجرا را متناسب با هدف خود بهینه کنید.
- هنگامی که هیچ چیزی روی بلات شما وجود ندارد، مطمئن شوید که کیت بلاتینگ به ترتیب درست کنار هم قرار گرفته است و جریان در جهت درست حرکت می کند، در غیر این صورت نمونه شما در بافر لکه(نشانه گذاری) می شود.
- زمانی که به نظر می رسد لکه گذاری کثیف یا تکه تکه باشد، اطمینان حاصل کنید که هیچ حبابی بین ژل و غشاء در هنگام تنظیم انتقال باقی نمی ماند. اطمینان حاصل کنید که غشاء به طور کامل در آب غوطه ور شده و به آرامی در مراحل انکوباسیون و شستشو مخلوط شده است تا نتیجه یکنواختی ایجاد شود. از معرف مسدود کننده تازه استفاده کنید.
- اگر نتایج نمونههای کنترل با نتیجه مورد انتظار ناسازگار است، غلظت آنتیبادی را بهینه کنید تا اتصال غیر اختصاصی یا خارج از هدف را به حداقل برسانید. مفروضات و مفاهیم تجربی خود را نیز بررسی کنید.
- باندها در لکه (نشانه گذاری)نهایی به سختی دیده می شوند (به صورت خیلی تاریک یا روشن)، زمان توسعه را در مرحله تشخیص بهینه کنید تا قدرت سیگنال را افزایش یا کاهش دهید. اگر نوارها خیلی روشن به نظر می رسند، ممکن است نشان دهنده شستشوی بیش از حد باشد. بهینه سازی غلظت آنتی بادی و در نظر گرفتن انتخاب نوع آنتی بادی نیز ممکن است کمک کننده باشد.